Почвовед.рф » Почвенная нематода — сеятель
Крошечная почвенная нематода Caenorhabditis elegans расширяет свою кормовую базу, рассевая бактерии, которыми потом и питается.
На рис. 1. Нематоду поместили рядом с колонией кишечной палочки, которая обведена красным пунктиром. На фотографии, сделанной спустя четверо суток, видны небольшие колонии, выросшие по пути следования червя. На выноске — черви, посетившие эти колонии.
C. elegans населяет преимущественно гниющую органику, где много бактерий. Такие ресурсы быстро истощаются, поэтому популяции нематод подвержены резкому колебанию численности. В поисках пищи черви вынуждены постоянно перемещаться, отыскивая богатые охотничьи угодья. Однако, как показали специалисты Принстонского университета, C. elegans умеют делать свою среду обитания более однородной.
В центре чашки Петри с плотной питательной средой для роста бактерий исследователи вырастили небольшой круглый газончик кишечной палочки Escherichia coli.
Чаще всего бактерии прилипают к влажному телу нематоды, когда она проползает по плотной колонии, а затем отваливаются во время странствий по агаровым просторам. Кроме того, червь переваривает не всех бактерий, которых проглотил, некоторые остаются неповрежденными и выходят наружу вместе с фекалиями. Когда из оставленных на пути следования клеток образуются колонии, червям остается лишь вернуться по собственным следам и съесть посеянное. В естественных условиях нематоды распространяют бактерии, когда заселяют гниющие фрукты или пористую почву.
Размазывая бактерии по чашке, черви N2 снижают плотность исходной колонии и способствуют образованию более мелких. Такие колонии растут быстрее, поскольку им доступнее питательные вещества. Подобное поведение можно назвать бактериальным фермерством. Потребитель (нематода) фактически разводит бактерий, улучшая их доступ к питательным веществам, способствуя таким образом росту их численности и получая от этого свои преимущества.
Такие колонии растут быстрее, поскольку им доступнее питательные вещества. Подобное поведение можно назвать бактериальным фермерством. Потребитель (нематода) фактически разводит бактерий, улучшая их доступ к питательным веществам, способствуя таким образом росту их численности и получая от этого свои преимущества.
Увы, всегда найдутся расхитители чужих посевов и стад. Не все C. elegans в состоянии хозяйствовать. Исследователи повторили эксперимент с нематодами, мутантными по гену srf-3. Мутация меняет свойства покровов червя таким образом, что бактерии к ним не прилипают. Черви srf-3 перемещаются по чашке не менее активно, чем N2, однако бактерий практически не переносят. Эти различия сказываются на динамике популяций разных штаммов: в одинаковых условиях численность мутантов растет медленнее. Если же обеспечить червям srf-3 бактериальный газон такой же площади, какую засевают N2, мутанты будут активно размножаться. Таким образом, преимущества N2 объясняются именно их фермерством.
Эксперименты показали, что в смешанной популяции мутанты пользуются плодами трудов N2 в той же степени, что и сами фермеры. На чашке с бактериями нет пространственного разделения между трудягами и нахлебниками, и их численность растет одинаково. Фермерам не мешают даже энергетические затраты на разведение бактерий. Правда, в лаборатории больших затрат и не требуется, однако в естественных условиях дело обстоит иначе. В почве встречаются не только съедобные бактерии, но и другие микроорганизмы, патогенные для нематод. Таким образом, фермеры, расселяющие бактерии, рискуют заразиться и погибнуть. Нелипкие мутанты более устойчивы к патогенам. Вторая проблема фермеров — активное пищевое поведение, которое мешает уделять достаточно времени размножению. Последствия такого поведения ученые наблюдали в лаборатории. Если посеять колонию E. coli в чашку большего диаметра — не 9, а 15 см, — черви N2 расселяют бактерий по всей площади агара. Численность кишечной палочки заметно возрастает, количество нематод увеличивается вдвое.
Разработанная исследователями математическая модель показала, что наличие патогенных бактерий и активное обследование обширных территорий сокращает численность фермеров по сравнению с ситуацией, когда патрулируемая в поисках пищи площадь невелика. В таких условиях в смешанной популяции преимущества получают мутанты, которые реже болеют и которым при этом бесплатно достаются плоды фермерских трудов. Однако в однородной популяции, состоящей из нематод одного фенотипа, фермеры всё же достигают более высокой плотности, чем мутанты.
С. elegans и E. coli — прекрасно изученные лабораторные объекты. Взаимоотношения между ними представляют, по мнению ученых, удобную модель для изучения аналогичных процессов в более сложных системах. Например, обнаруженные закономерности напоминают ученым распространение семян и перенос инфекции. Экспериментально исследовать эти процессы сложно и долго. А система «нематода — бактерии» позволит быстро проверять связанные с ними гипотезы. Исследователи даже проводят параллель между фермерством C. elegans и первых земледельцев, которые несли собранные семена в свои поселения, просыпая по дороге, и со временем всё больше и больше пшеницы колосилось вдоль излюбленных троп людей и рядом с их домами.
Экспериментально исследовать эти процессы сложно и долго. А система «нематода — бактерии» позволит быстро проверять связанные с ними гипотезы. Исследователи даже проводят параллель между фермерством C. elegans и первых земледельцев, которые несли собранные семена в свои поселения, просыпая по дороге, и со временем всё больше и больше пшеницы колосилось вдоль излюбленных троп людей и рядом с их домами.
Источник: https://elementy.ru/nauchno-populyarnaya_biblioteka/433827/Nematoda_seyatel
сеятель — Троицкий вариант — Наука
Наталья РезникМатериальные блага в этом мире распределены неравномерно, и животные, чтобы себя ими обеспечить, выкручиваются как могут. Крошечная почвенная нематода Caenorhabditis elegans, один из любимых лабораторных объектов, расширяет свою кормовую базу, рассевая бактерии, которыми потом и питается.
C. elegans населяет преимущественно гниющую органику, где много бактерий. Такие ресурсы быстро истощаются, поэтому популяции нематод подвержены резкому колебанию численности. В поисках пищи черви вынуждены постоянно перемещаться, отыскивая богатые охотничьи угодья. Однако, как показали специалисты Принстонского университета, C. elegans умеют делать свою среду обитания более однородной [1].
В поисках пищи черви вынуждены постоянно перемещаться, отыскивая богатые охотничьи угодья. Однако, как показали специалисты Принстонского университета, C. elegans умеют делать свою среду обитания более однородной [1].
 На фотографии, сделанной спустя четверо суток, видны небольшие колонии, выросшие по пути следования червя. На выноске — черви, посетившие эти колонии [1]2. C. elegans переваривает не всё, что глотает. Стрелка указывает на фекалии червя, содержащие бактерии [1]Чаще всего бактерии прилипают к влажному телу нематоды, когда она проползает по плотной колонии, а затем отваливаются во время странствий по агаровым просторам (рис. 1). Кроме того, червь переваривает не всех бактерий, которых проглотил, некоторые остаются неповрежденными и выходят наружу вместе с фекалиями (рис. 2). Исследователи даже записали происходящее на видеокамеру [2]. Когда из оставленных на пути следования клеток образуются колонии, червям остается лишь вернуться по собственным следам и съесть посеянное. В естественных условиях нематоды распространяют бактерии, когда заселяют гниющие фрукты или пористую почву.
На фотографии, сделанной спустя четверо суток, видны небольшие колонии, выросшие по пути следования червя. На выноске — черви, посетившие эти колонии [1]2. C. elegans переваривает не всё, что глотает. Стрелка указывает на фекалии червя, содержащие бактерии [1]Чаще всего бактерии прилипают к влажному телу нематоды, когда она проползает по плотной колонии, а затем отваливаются во время странствий по агаровым просторам (рис. 1). Кроме того, червь переваривает не всех бактерий, которых проглотил, некоторые остаются неповрежденными и выходят наружу вместе с фекалиями (рис. 2). Исследователи даже записали происходящее на видеокамеру [2]. Когда из оставленных на пути следования клеток образуются колонии, червям остается лишь вернуться по собственным следам и съесть посеянное. В естественных условиях нематоды распространяют бактерии, когда заселяют гниющие фрукты или пористую почву.Размазывая бактерии по чашке, черви N2 снижают плотность исходной колонии и способствуют образованию более мелких. Такие колонии растут быстрее, поскольку им доступнее питательные вещества. Подобное поведение можно назвать бактериальным фермерством. Потребитель (нематода) фактически разводит бактерий, улучшая их доступ к питательным веществам, способствуя таким образом росту их численности и получая от этого свои преимущества.
Такие колонии растут быстрее, поскольку им доступнее питательные вещества. Подобное поведение можно назвать бактериальным фермерством. Потребитель (нематода) фактически разводит бактерий, улучшая их доступ к питательным веществам, способствуя таким образом росту их численности и получая от этого свои преимущества.
Увы, всегда найдутся расхитители чужих посевов и стад. Не все C. elegans в состоянии хозяйствовать. Исследователи повторили эксперимент с нематодами, мутантными по гену srf-3. Мутация меняет свойства покровов червя таким образом, что бактерии к ним не прилипают. Черви srf-3 перемещаются по чашке не менее активно, чем N2, однако бактерий практически не переносят. Эти различия сказываются на динамике популяций разных штаммов: в одинаковых условиях численность мутантов растет медленнее. Если же обеспечить червям srf-3 бактериальный газон такой же площади, какую засевают N2, мутанты будут активно размножаться.
Эксперименты показали, что в смешанной популяции мутанты пользуются плодами трудов N2 в той же степени, что и сами фермеры. На чашке с бактериями нет пространственного разделения между трудягами и нахлебниками, и их численность растет одинаково. Фермерам не мешают даже энергетические затраты на разведение бактерий. Правда, в лаборатории больших затрат и не требуется, однако в естественных условиях дело обстоит иначе. В почве встречаются не только съедобные бактерии, но и другие микроорганизмы, патогенные для нематод. Таким образом, фермеры, расселяющие бактерии, рискуют заразиться и погибнуть. Нелипкие мутанты более устойчивы к патогенам. Вторая проблема фермеров — активное пищевое поведение, которое мешает уделять достаточно времени размножению. Последствия такого поведения ученые наблюдали в лаборатории. Если посеять колонию E.
 Численность кишечной палочки заметно возрастает, количество нематод увеличивается вдвое. Однако значение 15 см оказалось критическим для червей. На этой площади численность их популяции максимальна, при дальнейшем увеличении радиуса она падает: у нематод, занятых исследованием доступных пространств, снижается рождаемость.
Численность кишечной палочки заметно возрастает, количество нематод увеличивается вдвое. Однако значение 15 см оказалось критическим для червей. На этой площади численность их популяции максимальна, при дальнейшем увеличении радиуса она падает: у нематод, занятых исследованием доступных пространств, снижается рождаемость.Разработанная исследователями математическая модель показала, что наличие патогенных бактерий и активное обследование обширных территорий сокращает численность фермеров по сравнению с ситуацией, когда патрулируемая в поисках пищи площадь невелика. В таких условиях в смешанной популяции преимущества получают мутанты, которые реже болеют и которым при этом бесплатно достаются плоды фермерских трудов. Однако в однородной популяции, состоящей из нематод одного фенотипа, фермеры всё же достигают более высокой плотности, чем мутанты.
С. elegans и E. coli — прекрасно изученные лабораторные объекты. Взаимоотношения между ними представляют, по мнению ученых, удобную модель для изучения аналогичных процессов в более сложных системах. Например, обнаруженные закономерности напоминают ученым распространение семян и перенос инфекции. Экспериментально исследовать эти процессы сложно и долго. А система «нематода — бактерии» позволит быстро проверять связанные с ними гипотезы. Исследователи даже проводят параллель между фермерством C. elegans и первых земледельцев, которые несли собранные семена в свои поселения, просыпая по дороге, и со временем всё больше и больше пшеницы колосилось вдоль излюбленных троп людей и рядом с их домами. Красивая аналогия.
Например, обнаруженные закономерности напоминают ученым распространение семян и перенос инфекции. Экспериментально исследовать эти процессы сложно и долго. А система «нематода — бактерии» позволит быстро проверять связанные с ними гипотезы. Исследователи даже проводят параллель между фермерством C. elegans и первых земледельцев, которые несли собранные семена в свои поселения, просыпая по дороге, и со временем всё больше и больше пшеницы колосилось вдоль излюбленных троп людей и рядом с их домами. Красивая аналогия.
Наталья Резник
1. Thutupalli S., Uppaluri S., Constable G., Levin S., Stone H., Tarnita C., Brangwynne C. Farming and public goods production in Caenorhabditis elegans populations // Proc Natl Acad Sci USA.2017. 114. 2289–2294. doi: 10.1073/pnas.1608961114
2. www.pnas.org/content/suppl/2017/02/09/1608961114.DCSupplemental
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
См. также:
Золотистая картофельная нематода
Среди вредителей и болезней, поражающих картофель, нематодные болезни занимают одно из первых мест. Золотистая картофельная нематода (ЗКН) входит в перечень вредителей, болезней растений и сорняков, имеющих карантинное значение для Российской Федерации. В Калининградской области установлен один очаг золотистой картофельной нематоды на территории МО «Мамоновский ГО» общей площадью 107,6892 га.Золотистая картофельная нематода относится к круглым червям и является возбудителем опасного карантинного заболевания картофеля и томатов — глободероза. Цикл развития картофельной нематоды происходит в корнях растения-хозяина. Сохраняется нематода в почве в стадии цисты. Цисты могут распространяться с частицами зараженной почвы приставшей к клубням картофеля, корнеплодам, луковицам с различным укорененным посадочным материалом, а также с почвообрабатывающими орудиями, дождевыми водами и ветром. Зараженные растения отстают в росте, листья приобретают бледную окраску и со временем усыхают, урожай резко снижается.
 Золотистая картофельная нематода развивается и отличается особой вредоносностью преимущественно в частном секторе, где из года в год картофель возделывается на одном и том же месте. Потери урожая при сильном заражении почвы могут составить 70-90%.
Золотистая картофельная нематода развивается и отличается особой вредоносностью преимущественно в частном секторе, где из года в год картофель возделывается на одном и том же месте. Потери урожая при сильном заражении почвы могут составить 70-90%. Пораженные нематодой растения определить несложно, они имеют всего 1-3 стебля, образуют или мелкие клубни, или совсем не образуют. Стебли начинают преждевременно желтеть, начиная с нижних листьев. При сильном поражении, растения, чтобы получить питательные вещества и воду, образуют мелкие корни, так называемую «бородатость» корневой системы. Начиная с фазы массового цветения и до уборки урожая на корнях невооруженным глазом можно заметить мелких, с размером макового зерна, округлых самок. Они могут быть белого, желтого или золотистого цвета, а превращаясь в цисты (отмершие самки с жизнеспособным содержимым внутри – яйцами и личинками), становятся коричневыми или темно-бурыми. Осенью цисты отделяются от корней в почву, где и зимуют. Каждая циста содержит в среднем от 100 до 500 яиц и личинок.
 Оставшиеся в цистах личинки могут сохраняться живыми длительное время — до 10 лет и более.
Оставшиеся в цистах личинки могут сохраняться живыми длительное время — до 10 лет и более. Очень важно вовремя обнаружить картофельную нематоду и не допустить ее дальнейшего распространения. Необходимо соблюдать севооборот — картофель должен возвращаться в прежнее место не ранее, чем через 4 года. В этих промежутках можно возделывать непоражаемые нематодой культуры (многолетние травы, зерновые злаки, горох, капусту, чеснок, лук, огурцы, свеклу, кабачки). Своевременная локализация и ликвидация опасного карантинного вредителя предотвратит его массовое распространение и гибель урожая картофеля. Необходимо проводить систематическое обследование посадок картофеля с отбором почвенных проб для лабораторной экспертизы. escortnavi.com
При подозрении на выявление золотистой картофельной нематоды просим незамедлительно сообщать об этом в Управление Россельхознадзора по Калининградской области.
Нематоды почвенные
Почвенная биота представлена фауной и флорой.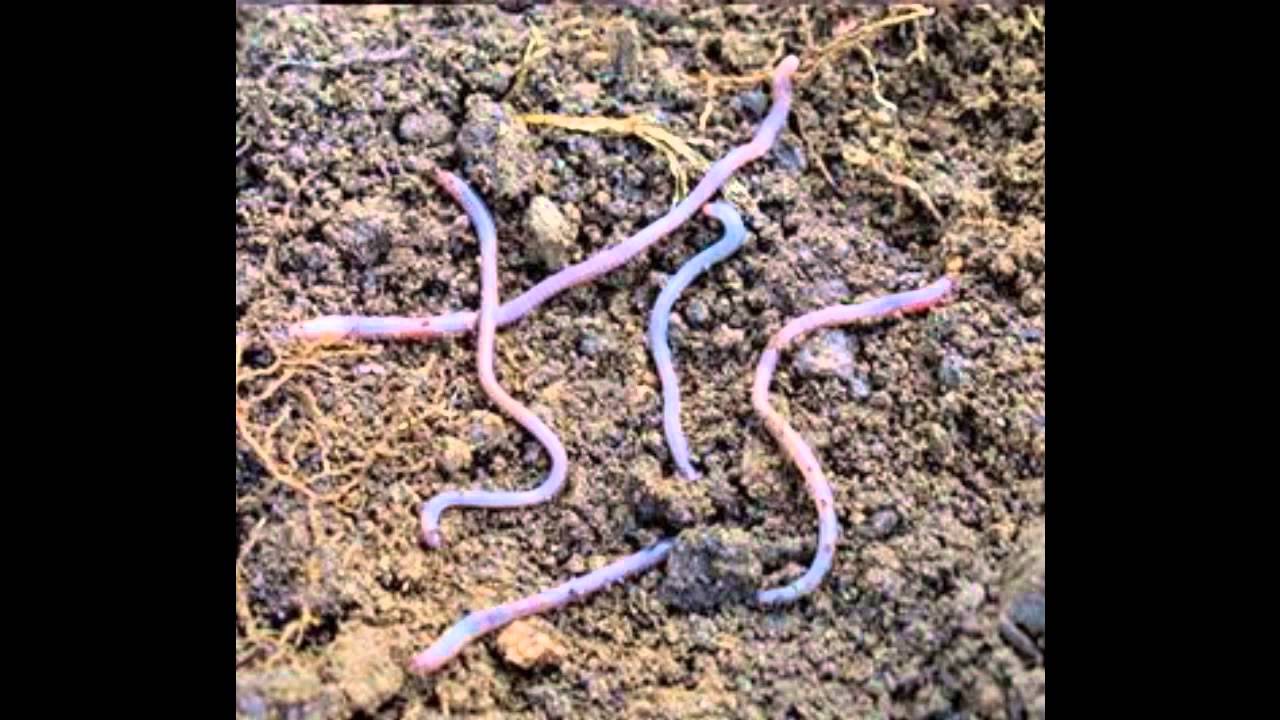 Фауна: дождевые черви, мокрицы, земляные клещи, нематоды и др., перераспределяют гумус и биогенные элементы, повышая ее плодородие. Огромную роль играют дождевые черви, вес которых может превышать вес пасущегося скота (их до пяти миллионов особей на гектар черноземной пашни). Они, по мнению Ч. Дарвина, пропускают через свой кишечник за несколько лет весь пахотный слой. Флора — это грибы, бактерии, водоросли и др., перерабатывают органику до исходных неорганических составляющих (деструкторы).[ …]
Фауна: дождевые черви, мокрицы, земляные клещи, нематоды и др., перераспределяют гумус и биогенные элементы, повышая ее плодородие. Огромную роль играют дождевые черви, вес которых может превышать вес пасущегося скота (их до пяти миллионов особей на гектар черноземной пашни). Они, по мнению Ч. Дарвина, пропускают через свой кишечник за несколько лет весь пахотный слой. Флора — это грибы, бактерии, водоросли и др., перерабатывают органику до исходных неорганических составляющих (деструкторы).[ …]
Почвенная биота представлена фауной и флорой. Фауна: дождевые черви, земляные клещи, нематоды и др., перераспределяет гумус и биогенные элементы, повышая ее плодородие. Флора — это грибы, бактерии, водоросли и др., перерабатывает органику до исходных неорганических составляющих (деструкторы).[ …]
Изучая почвенных нематод, Овергард-Нильсен (1949, 1949а) установил, что их плотность колеблется в пределах от 1 до 20 млн. на 1 м2. Многие нематоды питаются, по-видимому, бактериями, другие (до 40%) — корнями растений и почвенными водорослями и не более 2% питаются другими животными. Особенно много нематод в мюллевой (неорганической) почве, где их биомасса равна биомассе дождевых червей; в этом случае, однако, их дыхание должно быть в 10 раз выше] дыхания таких более крупных животных, как дождевые черви (Овергард-Нильсен, 1949а). В ряде сельскохозяйственных районов некоторые виды нематод являются опасными паразитами корней растений; устранить же их из зараженной почвы очень трудно. Наилучший способ борьбы с нематодами — севооборот. В отличие от нематод микроартроподы и энхитреиды достигают максимальной биомассы в лесных и органических почвах (табл. 47).[ …]
Особенно много нематод в мюллевой (неорганической) почве, где их биомасса равна биомассе дождевых червей; в этом случае, однако, их дыхание должно быть в 10 раз выше] дыхания таких более крупных животных, как дождевые черви (Овергард-Нильсен, 1949а). В ряде сельскохозяйственных районов некоторые виды нематод являются опасными паразитами корней растений; устранить же их из зараженной почвы очень трудно. Наилучший способ борьбы с нематодами — севооборот. В отличие от нематод микроартроподы и энхитреиды достигают максимальной биомассы в лесных и органических почвах (табл. 47).[ …]
Испытания показали, что гетерофос — эффективный почвенный не-матоцид, обладающий рядом положительных свойств. При внесении в почву гетерофос был эффективен против галловых, цистообразующих и других форм нематод. Испытания против цистообразующей картофельной нематоды показали перспективность его применения в сочетании с устойчивыми к этому паразиту сортами картофеля.[ …]
Хищные грибы можно рассматривать как экологическую группу почвенных сапрофитов, в процессе эволюции приобретших способность улавливать нематод и питаться дополнительно. Хищничество у грибов появилось, вероятно, в глубокой древности, причем возникло независимо в разных их группах. У гифомицетов этот способ питания должен быть достаточно древнего происхождения, на что указывает их широкое распространение во всех климатических зонах и наличие сложных ловчих приспособлений (Ф. Ф. С о п р у н о в).[ …]
Хищничество у грибов появилось, вероятно, в глубокой древности, причем возникло независимо в разных их группах. У гифомицетов этот способ питания должен быть достаточно древнего происхождения, на что указывает их широкое распространение во всех климатических зонах и наличие сложных ловчих приспособлений (Ф. Ф. С о п р у н о в).[ …]
Применяется для борьбы с картофельной нематодой на картофеле (0,5 кг на 10 м2). Вносится в почву осенью после уборки урожая или весной за 30 дней до посадки картофеля. Препарат равномерно и тщательно перемешивается с почвой на глубине пахотного слоя. Если почва сухая, то ее следует предварительно увлажнить (3—10 л воды на 1 м2). Кроме этого, тиазон рекомендован против корневой гнили и комплекса почвенных патогенов за 30 дней до посадки цветочных культур (3,2 кг на 10 м2).[ …]
Метилгорчичное масло оказывает токсическое действие не только на нематоды. Адсорбируясь в почве в газообразной форме, метилгорчичное масло сохраняется в ней довольно длительное время. Поэтому следует соблюдать время ожидания, равное 3—8 неделям.[ …]
Поэтому следует соблюдать время ожидания, равное 3—8 неделям.[ …]
Значительная часть органического вещества водорослей становится пищей различных почвенных животных: простейших, клещей, нематод, знхитреид, кивсяков, дождевых червей, личинок некоторых насекомых. Так, одна энхи-треида съедала за сутки до 320 тыс. клеток хлореллы или 100 тыс. клеток ностока. По-видимо-му, почвенные животные являются одним из важных факторов, определяющих динамику численности водорослей.[ …]
Самые мелкие почвенные животные — простейшие, несмотря на многочисленность по причине ничтожных размеров, имеют небольшую массу. Относительно крупные представители почвенных позвоночных (змеи, ящерицы, грызуны и проч.) составляют менее 1% суммарной зоомассы в силу малочисленности. Оказалось, что зоомасса определяется почвенной мезофауной, т. е. беспозвоночными: членистоногими, нематодами, дождевыми червями и др.[ …]
Биологические свойства. Предлагается для экспериментального использования в качестве почвенного фумиганта для борьбы с грибками, нематодами и семенами сорняков; как утверждают, нет необходимости применять какое-либо специальное покрытие почвы. [ …]
[ …]
В принципе обработка почвы нематоцидами должна обеспечивать защиту растений от вирусов, распространяемых нематодами. Передвижение и распространение нематод происходит обычно медленно, а потому можно рассчитывать, что действие одной такой обработки будет длиться дольше, чем действие инсектицидов. С другой стороны, как указывает Сол 11037], инфекционные нематоды могут встречаться и па значительной глубине. С помощью почвенных проб, взятых на глубине до 80—100 см, удавалось заражать растения вирусом погремковости табака. Следовательно, вполне возможно, что обработанная почва будет вновь заселяться нематодами из более глубоких слоев, т. е. из тех мест, где они избежали действия фумигации.[ …]
Мезобиотип (мезобиота) — совокупность сравнительно мелких, легко извлекающихся из почвы, подвижных животных (почвенные нематоды, личинки насекомых, клещи, ногохвостки и др.).[ …]
Результаты, получаемые в последнее время, свидетельствуют о том, что фаготрофы, особенно мелкие животные (простейшие, почвенные клещи, коллемболы, нематоды, остракоды. улитки и т. д.), играют более значительную роль в процессах разложения, чем предполагалось ранее. Как показали данные трех экспериментальных исследовании, приведенные на рис. 2.11, после селективного удаления этой микрофауны разложение отмершего растительного материала сильно замедляется. Хотя многие питающиеся детритом животные (детритофаги) на самом деле не могут переваривать лигноцеллюлозный комплекс п получают энергию пищи главным образом от микрофлоры, развивающейся на этом же материале, они ускоряют разложение растительного-опада различными непрямыми путями: 1) измельчая детрит и таким образом увеличивая площадь поверхности, доступную для воздействия микроорганизмов; 2) вводя в среду белки или ростовые вещества (часто содержащиеся в выделениях животных), стимулирующие рост микроорганизмов; и 3) стимулируя рост и метаболическую активность микробных популяций, постоянно выедая часть бактерий и грибов. Наконец, многие детритоядные животные являются копрофагами (от греч. kopros— навоз), т.
улитки и т. д.), играют более значительную роль в процессах разложения, чем предполагалось ранее. Как показали данные трех экспериментальных исследовании, приведенные на рис. 2.11, после селективного удаления этой микрофауны разложение отмершего растительного материала сильно замедляется. Хотя многие питающиеся детритом животные (детритофаги) на самом деле не могут переваривать лигноцеллюлозный комплекс п получают энергию пищи главным образом от микрофлоры, развивающейся на этом же материале, они ускоряют разложение растительного-опада различными непрямыми путями: 1) измельчая детрит и таким образом увеличивая площадь поверхности, доступную для воздействия микроорганизмов; 2) вводя в среду белки или ростовые вещества (часто содержащиеся в выделениях животных), стимулирующие рост микроорганизмов; и 3) стимулируя рост и метаболическую активность микробных популяций, постоянно выедая часть бактерий и грибов. Наконец, многие детритоядные животные являются копрофагами (от греч. kopros— навоз), т. е. их обычная пиша — экскременты, обогащенные питательными веществами за счет жизнедеятельности поселяющихся на них микроорганизмов (Newell, 1965; Frankenberg, Smith, 1967). Например, жук Popilius, живущий в трухлявых стволах деревьев, использует своп ходы в древесине как своеобразный «внешний рубец>>, где экскременты и размельченные частицы древесины обогащаются за счет жизнедеятельности грибов, а затем снова поедаются жуком (Mason, Odum, 1969). В этом случае копрофагия основана на взаимодействии насекомого и гриба — взаимодействии, которое облегчает жуку использование энергии пищи и ускоряет разложение древесины. В море фекалии пелагических оболочников так называемых сальн, питающихся микрофлорой, отфильтрованной ими из воды, служат, как было показано, важным источником пищи для других морских животных, в том числе для рыб.[ …]
е. их обычная пиша — экскременты, обогащенные питательными веществами за счет жизнедеятельности поселяющихся на них микроорганизмов (Newell, 1965; Frankenberg, Smith, 1967). Например, жук Popilius, живущий в трухлявых стволах деревьев, использует своп ходы в древесине как своеобразный «внешний рубец>>, где экскременты и размельченные частицы древесины обогащаются за счет жизнедеятельности грибов, а затем снова поедаются жуком (Mason, Odum, 1969). В этом случае копрофагия основана на взаимодействии насекомого и гриба — взаимодействии, которое облегчает жуку использование энергии пищи и ускоряет разложение древесины. В море фекалии пелагических оболочников так называемых сальн, питающихся микрофлорой, отфильтрованной ими из воды, служат, как было показано, важным источником пищи для других морских животных, в том числе для рыб.[ …]
Основная функция животных организмов в почве — преобразование органических веществ. В почвообразовании принимают участие как почвенные, так и наземные животные. В почвенной среде животные представлены главным образом беспозвоночными и простейшими. Некоторое значение имеют также позвоночные (например, кроты и др.), постоянно живущие в почве. Почвенные животные делятся на две группы: биофагов, питающихся живыми организмами или тканями животных организмов, и сапрофагов, использующих в пищу органическое вещество. Главную массу почвенных животных составляют сапрофаги (нематоды, дождевые черви и др.). На 1 га почвы приходится более 1 млн простейших, на 1 м — десятки червей, нематод и других сапрофагов. Огромная масса сапрофагов, поедая мертвые растительные остатки, выбрасывает в почву экскременты. Согласно подсчетам Ч. Дарвина, почвенная масса в течение нескольких лет полностью проходит через пищеварительный тракт червей. Сапрофаги влияют на формирование почвенного профиля, содержание гумуса, мощность гумусовых горизонтов, структуру почвы.[ …]
В почвенной среде животные представлены главным образом беспозвоночными и простейшими. Некоторое значение имеют также позвоночные (например, кроты и др.), постоянно живущие в почве. Почвенные животные делятся на две группы: биофагов, питающихся живыми организмами или тканями животных организмов, и сапрофагов, использующих в пищу органическое вещество. Главную массу почвенных животных составляют сапрофаги (нематоды, дождевые черви и др.). На 1 га почвы приходится более 1 млн простейших, на 1 м — десятки червей, нематод и других сапрофагов. Огромная масса сапрофагов, поедая мертвые растительные остатки, выбрасывает в почву экскременты. Согласно подсчетам Ч. Дарвина, почвенная масса в течение нескольких лет полностью проходит через пищеварительный тракт червей. Сапрофаги влияют на формирование почвенного профиля, содержание гумуса, мощность гумусовых горизонтов, структуру почвы.[ …]
Мезобиотип, мезобиота — это совокупность сравнительно мелких, легко извлекающихся из почвы, подвижных животных. Сюда относятся почвенные нематоды (Nematoda), мелкие личинки насекомых, клещи (Oribatee), ногохвостки (Collembola) и др. Эта группа весьма многочисленна — от десятков и сотен тысяч до миллионов особей на 1м2 почвы. Питаются в основном детритом и бактериями. Клещи и насекомые нередко являются хищниками. Отдельные виды нематод паразитируют в корнях растений, зачастую сильно их повреждая.[ …]
Сюда относятся почвенные нематоды (Nematoda), мелкие личинки насекомых, клещи (Oribatee), ногохвостки (Collembola) и др. Эта группа весьма многочисленна — от десятков и сотен тысяч до миллионов особей на 1м2 почвы. Питаются в основном детритом и бактериями. Клещи и насекомые нередко являются хищниками. Отдельные виды нематод паразитируют в корнях растений, зачастую сильно их повреждая.[ …]
Питание культур в разные периоды их роста можно изменять, варьируя состав питательного раствора, что неосуществимо в такой степени в почвенных теплицах. При выращивании рассады на щебне исключается возможность заражения молодых растений галловой нематодой, являющейся бичом тепличной культуры. Переносчиками ее считают торф и перегной, вследствие чего и важно их исключение при гидропонном возделывании растений.[ …]
Известны многочисленные примеры паразитирования бактерий на мицелии грибов, хищных грибов, активно захватывающих и лизи-рующих мелких почвенных червей (нематод).[ …]
Кольцевая пятнистость смородины. Возбудитель — вирус кольцевой пятнистости малины (raspberry ring-spot virus). Частицы его изометрические, диаметром около 30 им. Передается соком, почвенными нематодами рода Longidorus Hooper и прививкой.[ …]
Возбудитель — вирус кольцевой пятнистости малины (raspberry ring-spot virus). Частицы его изометрические, диаметром около 30 им. Передается соком, почвенными нематодами рода Longidorus Hooper и прививкой.[ …]
Большое количество органического материала в почвах стабилизирует режим увлажненности последних и обеспечивает благоприятные микроусловия для существования простейших, нематод и коловраток, которые обитают в интерстициальной водной пленке. Этих животных очень мало в прогретых, сухих минерализованных почвах тропиков. Обогащенные органическим веществом почвы в лесах умеренной зоны занимают промежуточное положение. Численность большинства других групп животных по направлению к более засушливым тропикам уменьшается; там их замещают термиты.[ …]
В настоящее время для повышения урожайности применяют различные химические средства. Часть их предназначена для борьбы с возбудителями грибковых заболеваний, бактериями, вирусами и нематодами (червями). Серьезная проблема — заболевания корневой системы растений, например ложная мучнистая роса кукурузы и сорго. В последнее время появились почвенные фунгициды для защиты корневой системы. Отдельные химические соединения очень эффективны при обработке семян, при этом уничтожаются занесенные или существующие в них микроорганизмы.[ …]
В последнее время появились почвенные фунгициды для защиты корневой системы. Отдельные химические соединения очень эффективны при обработке семян, при этом уничтожаются занесенные или существующие в них микроорганизмы.[ …]
Литосфера — это твердая поверхность Земли, представленная ее верхними водонепроницаемыми слоями глубиной до 2-5 км, ниже которых уже лежат осадочные породы, а еще ниже — переплавленные породы гранитной оболочки. Объем почвенного слоя, в котором обнаруживают жизнь, составляет около 100 000 км®. Почва заселена такими организмами как бактерии, корненожки, инфузории, черви (нематоды), олигохеты, насекомые, клещи, мелкие млекопитающие, растения.[ …]
Возбудители — вирус мозаики резухи (ara-bis mosaic virus) и вирус кольцевой пятнистости малины (raspberry ringspol virus). Оба вируса относятся к одной группе, имеют изометрические частицы диаметром около :Ю им. Переносятся контактно-механическим путем, почвенными нематодами и прививкой. На листьях светло-зеленые или желтоватые пятна, разной величины и формы с нечеткими краями. Листья мелкие, деформированные, растения угнетены. При сильном поражении растения восприимчивых сортов погибают в течение года.[ …]
Листья мелкие, деформированные, растения угнетены. При сильном поражении растения восприимчивых сортов погибают в течение года.[ …]
В 1912 г. швейцарец Р. Франсе выступил в «Почвоведении» с идеей о специфической форме сосуществования растительных п животных организмов, приспособленных к условиям обптаиия в почве; по аналогии с водным сообществом «планктоном» он назвал совокупность почвенных организмов «геобионтов»— «эдафоиом». Последний в почве разделяется на два яруса: более глубокий, не страдающий от зимних холодов и мало страдающий от засухи, и поверхностный, в котором отчетливо проявляются эти отрицательные экологические факторы. Кроме хорошо известных и до него почвенных бактерий, насекомых, дождевых червей, Франсе установил в почве большое видовое разнообразие и высокую численность грибов, простейших, нематод и др. Он привел некоторые данные о глубине проникновения разных геобионтов в почву и связи их с характером растительности. Ограниченность материала не позволила Франсе увидеть зональный характер эдафоиа. [ …]
[ …]
На гидропонные гряды рекомендуется высаживать рассаду, выращенную гидропонным способом. Выращенную в почве рассаду перед посадкой на гидропонные гряды следует тщательно промыть теплой водой, чтобы на корнях не оставались частицы земли. Вместе с почвенной рассадой можно занести в гряды нематод.[ …]
Обыкновенная и крапчатая мозаики (рис. 47, 1). Возбудители— мозаичные вирусы X, S, М, Y, A, F, R. Они имеют палочковидные или нитевидные частицы и могут передаваться контактно-механическим путем. Другие пути передачи инфекции различны: вирусы S, М, Y, A, F переносятся тлями, R — почвенными нематодами. Кроме мозаик, вирусы этой группы могут вызывать и более тяжелые симптомы: деформацию листьев и клубней, некрозы всех частей растения, общее угнетение роста и развития.[ …]
Детритофаги обитают в наземных местообитаниях всех типов, они часто представлены удивительно большим числом видов и достигают высокой численности. Так, например, на квадратном метре почвы в лесах умеренной зоны можно обнаружить около 1000 видов животных, при этом численность нематод и простейших может превышать 10 млн. ; ногохвосток (Collem-bola) и почвенных клещей (Acari) — 100 000; других беспозвоночных— около 50 000 (Anderson, 1978). Относительное значение микрофауны, мезофауны и макрофауны в наземных сообществах изменяется в меридиональном направлении (рис. 11.6). Микрофауна играет относительно большую роль в богатых органикой почвах северных лесов, тундры и полярной пустыни. Большое количество органического материала в них стабилизирует режим увлажненности почвы и обеспечивает благоприятные микроусловия для простейших, нематод и коловраток, которые обитают в интерстициальной водной пленке. Этих животных очень мало в прогретых, сухих минерализованных почвах тропиков. Глубокие обогащенные органическим веществом почвы в лесах умеренной зоны занимают промежуточное положение; в них поддерживается самая высокая численность популяций почвенных клещей, ногохвосток и энхитреид, относящихся к мезофауне. Численность в большинстве других групп животных по направлению к более засушливым тропикам уменьшается, там их замещают термиты.
; ногохвосток (Collem-bola) и почвенных клещей (Acari) — 100 000; других беспозвоночных— около 50 000 (Anderson, 1978). Относительное значение микрофауны, мезофауны и макрофауны в наземных сообществах изменяется в меридиональном направлении (рис. 11.6). Микрофауна играет относительно большую роль в богатых органикой почвах северных лесов, тундры и полярной пустыни. Большое количество органического материала в них стабилизирует режим увлажненности почвы и обеспечивает благоприятные микроусловия для простейших, нематод и коловраток, которые обитают в интерстициальной водной пленке. Этих животных очень мало в прогретых, сухих минерализованных почвах тропиков. Глубокие обогащенные органическим веществом почвы в лесах умеренной зоны занимают промежуточное положение; в них поддерживается самая высокая численность популяций почвенных клещей, ногохвосток и энхитреид, относящихся к мезофауне. Численность в большинстве других групп животных по направлению к более засушливым тропикам уменьшается, там их замещают термиты. [ …]
[ …]
Биологические свойства. Эффективный фунгицид для защиты саженцев от Pythium и Rhizoctonia при внесении в почву 166 частей на 1 млн. и на листве против мучнистой росы при концентрации 0,1%. Рекомендуется для использования в качестве фунгицида и гербицида в дозе 55—165 кг!га. Рекомендуется для борьбы с почвенными нематодами при концентрации 5 частей на 1 млн. Острая пероральная LD50 для самцов белых мышей 650 мг/ кг, плохо абсорбируется кожей, не вызывает раздражения.[ …]
Биологические свойства. Инсектицидный фумигант. Используется против некоторых вредителей на продовольственных складах (Aman J. et al., Ann. Кроме того, препарат используется для обработки почвы против некоторых почвенных насекомых и нематод (Stone М. W., U. S. Dept. Фитотоксичен, поэтому посев проводится через восемь дней после обработки почвы. Ядовит, вызывает появление нарывов; острая пероральная LDao для крыс (самцов) составляет 146 мг/кг (Rowe V. К-et al., Arch. Крысы выдерживали концентрацию в 25 частей на 1 млн. при воздействии в течение 7 часов, в течение 6 месяцев по 5 дней в неделю.[ …]
при воздействии в течение 7 часов, в течение 6 месяцев по 5 дней в неделю.[ …]
Последний является действующим началом. Кроме того, в состав препарата ДД входит также хлористый аллил (до 12%) и полихлориды ряда пропана (до 10%). Препарат ДД жидкость темно-бурого цвета со специфическим запахом; не растворяется в воде, растворима в органических растворителях. Применяется в качестве эффективного почвенного фумиганта, а также для борьбы с нематодами.[ …]
Бактерии, дрожжи и плесневые грибы могут участвовать в процессе разложения одновременно или поочередно. Бактерии, по-видимому, играют главную роль в разрушении мягких тканей животных, а грибы, вероятно, важнее для разрушения древесины. Трайб (1957, 1961) описывает интересную смену организмов, полностью разложивших целлюлозную пленку, которую он поместил в почву. Первыми на пленке поселились грибы; бактерии в значительном количестве появились позднее. Когда пленка была измельчена, появились нематоды и другие почвенные беспозвоночные, которые стали пожирать мелкие частицы пленки (разумеется, вместе с микроорганизмами). За время медленного разложения крупных организмов на них создаются местообитания для самых разных организмов. Например, на упавшем стволе в лесу возникает хорошо развитое подсообщество, которое изменяется по мере разложения ствола.[ …]
За время медленного разложения крупных организмов на них создаются местообитания для самых разных организмов. Например, на упавшем стволе в лесу возникает хорошо развитое подсообщество, которое изменяется по мере разложения ствола.[ …]
Беспозвоночные, которые принимают участие в разложении мертвого растительного и животного материала, принадлежат к самым разнообразным таксономическим группам. В наземных биотопах их обычно разделяют по размерным группам. Размеры— это не просто произвольно выбранный признак для классификации; размеры являются важной характеристикой организмов, которым приходится добираться до пищевых ресурсов, выкапывая норы или проползая в щели и ходы в листовой подстилке или почве. В состав микрофауны (включая специализированных животных, питающихся микроорганизмами) входят простейшие, нематоды и коловратки (рис. 11.4). Эти животные в основном ответственны за первоначальное размельчение растительных остатков. Благодаря своей активности они могут вызывать заметное перераспределение детрита и тем самым непосредственно участвовать в формировании структуры почвы.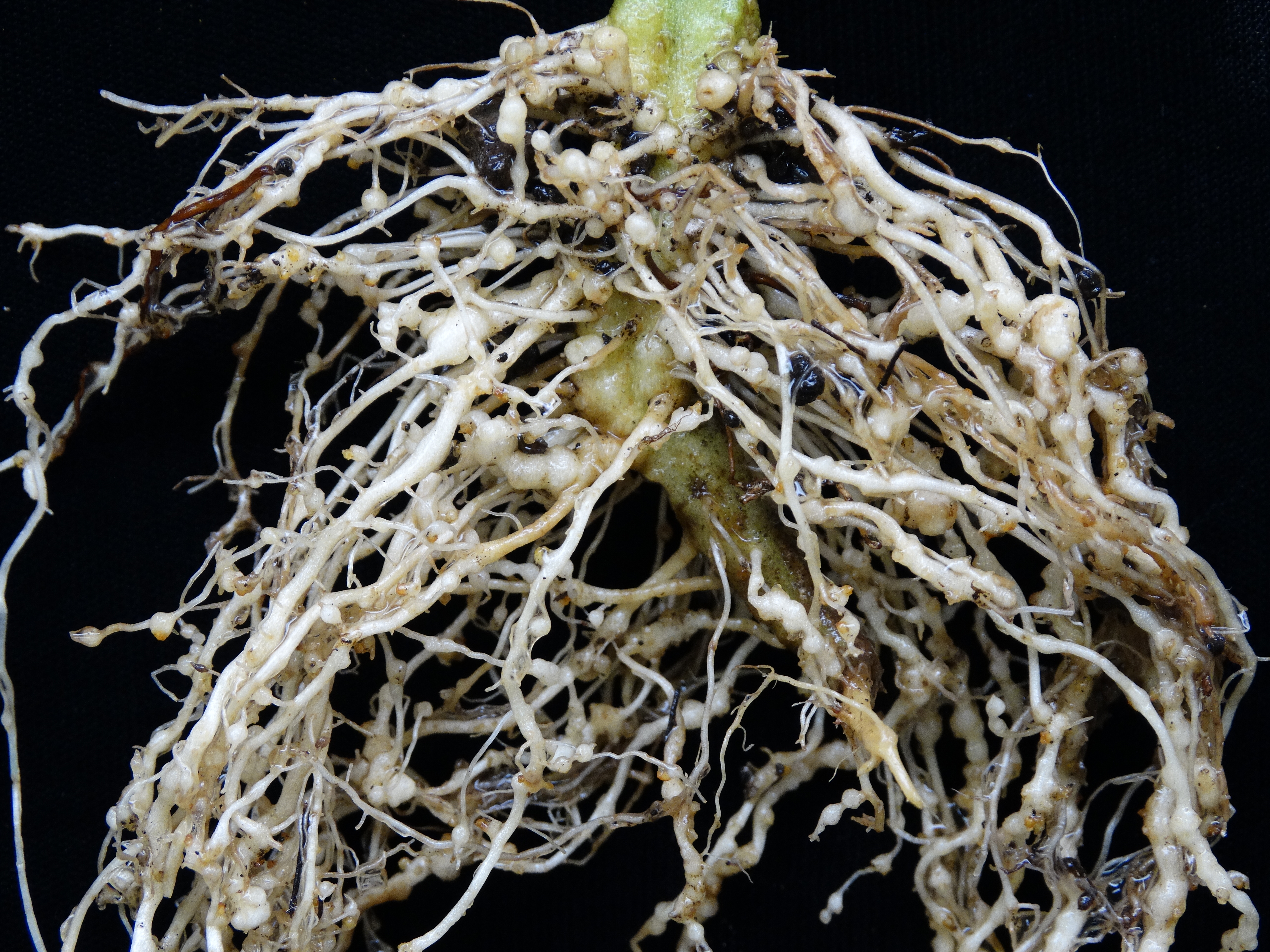 Организмы, обитающие в почве и лесной подстилке, перечислены на рис. 11.5.[ …]
Организмы, обитающие в почве и лесной подстилке, перечислены на рис. 11.5.[ …]
Центральная научно-методическая ветеринарная лаборатория
В Тульском отделе карантина растений и качества семян фитосанитарной испытательной лаборатории подведомственного Россельхознадзору ФГБУ ЦНМВЛ были проведены экспертизы почвенных образцов на выявление карантинных вредных организмов. В пятидесяти девяти случаях был обнаружен карантинный объект – Золотистая картофельная нематода (Globodera rostochiensis(Woll.)M.et.St.).
Золотистая картофельная нематода — микроскопический червь, самый опасный, карантинный вредитель картофеля. Картофельная нематода живет на корнях и в стеблях растений.
У кустов, зараженных нематодой, быстро отмирают и опадают нижние листья, а остальные — желтеют. Картофель не цветет, либо цветение скудное, формирование клубней заторможено, клубни мелкие, либо их нет. Главная причина распространения картофельной нематоды — неправильное чередование культур на участке или его полное отсутствие. Нематода есть практически на каждом огородном участке и в каждой любительской теплице, где из года в год сажают одни и те же культуры.
Нематода есть практически на каждом огородном участке и в каждой любительской теплице, где из года в год сажают одни и те же культуры.
Помните! Бдительность и своевременное выявление карантинных вредных организмов – главный залог фитосанитарного благополучия страны.
По всем вопросам проведения исследований на наличие карантинных объектов вы можете обратиться в отделы по работе с заказчиком и обращению с объектами исследований по следующим номерам телефонов:
г. Тула — 8(4872) 37-38-43,
г. Липецк — 8(4742) 79-73-65,
г. Рязань — 8(4912) 33-99-90,
г. Калуга — 8(4842) 79-33-17,
г. Самара — 8(846) 634-60-65.
Читать также: Специалисты ФГБУ ЦНМВЛ прошли аттестацию в качестве экспертов, привлекаемых к проведению контрольно-надзорных мероприятий 10.12.2018 подробнее Сотрудники Липецкой испытательной лаборатории прошли обучение по работе с сосудами под давлением 05. 07.2021
подробнее
Минсельхоз утвердил новые ветправила по содержанию пчел
02.11.2021
подробнее
07.2021
подробнее
Минсельхоз утвердил новые ветправила по содержанию пчел
02.11.2021
подробнееОпасный вредитель – картофельная нематода
Прошла пора уборки урожая популярного народного продукта – картофеля. Но наверное не все огородники могли порадоваться хорошему урожаю. И это может быть связано с опасным возбудителем заболевания картофеля и томатов – золотистой картофельной нематодой. Золотистая картофельная нематода является объектом внешнего и внутреннего карантина Росийской Федерации. В Александровском районе была выявлена золотистая картофельная нематода на приусадебных участках поселка Балакирево, на данную территорию был наложен карантин
Золотистая картофельная нематода(Globodera rostocbiensis) – это микроскопический круглый червь, паразитирующий на корнях картофеля. Сохраняется нематода в почве в стадии цисты до 10-15 лет. Весной, после высадки картофеля из цист выходят до 500 личинок, которые прикрепляются к корням картофеля и питаются их соком, приобретая шаровидную форму около 1 мм в диаметре. У пораженного растения при выкопке и просмотре корней (середина июля- начало августа) можно увидеть мелкие личинки 4 – ой стадии (размером с маковое зерно) золотисто-желтого цвета. К осени они отмирают, оболочка их буреет и превращаются в коричнево-бурую цисту, защищенную от неблагоприятных влияний среды.
Сохраняется нематода в почве в стадии цисты до 10-15 лет. Весной, после высадки картофеля из цист выходят до 500 личинок, которые прикрепляются к корням картофеля и питаются их соком, приобретая шаровидную форму около 1 мм в диаметре. У пораженного растения при выкопке и просмотре корней (середина июля- начало августа) можно увидеть мелкие личинки 4 – ой стадии (размером с маковое зерно) золотисто-желтого цвета. К осени они отмирают, оболочка их буреет и превращаются в коричнево-бурую цисту, защищенную от неблагоприятных влияний среды.
Растения картофеля при поражении нематодой отстают в росте, образуют мало стеблей, которые начинают преждевременно желтеть и отмирать. Цветение как правило отсутствует или очень скудное. Число клубней резко снижается, они мелкие, а при сильном поражении нематодой клубнеобразования не происходит, образуется только масса мелких мочковатых корней. Ко времени уборки картофеля созревшие цисты легко стряхиваются с корней и остаются в почве.
В начале заражения распознать нематоду очень сложно. Поврежденные кусты картофеля встречаются одиночно или очагами. Позже зараженным становится весь участок. Заражение обнаруживается через несколько лет в результате посадок картофеля в течении длительного времени на одном и том же месте.
Обычно картофельная нематода распространяется в стадии покоящихся цист. Цисты переносятся с посадочным материалом – клубнями картофеля, луковицами, корнеплодами, саженцами плодовых и ягодных культур. Так же могут распространятся на орудиях труда, упаковочной таре, транспорте, обуви человека, дождевой водой и ветром. Основная агротехническа мера защиты от золотистой картофельной нематоды является 4-5 польный севооборот. Наиболее хорошим предшественником являются бобовые травы (люпин), хорошие резельтаты дают злаково-бобовые смеси и чистый пар, а так же другие культуры, не поражаемые этим видом нематод. Возделывание нематодоустойчивых сортов картофеля, среди них Жуковский ранний, Ред Скарлет, Санте, Симфония, Алмаз, Каратоп, Импала, Карлена, Латона, Розара, Скарб, Хозяюшка, Юбиляр и др.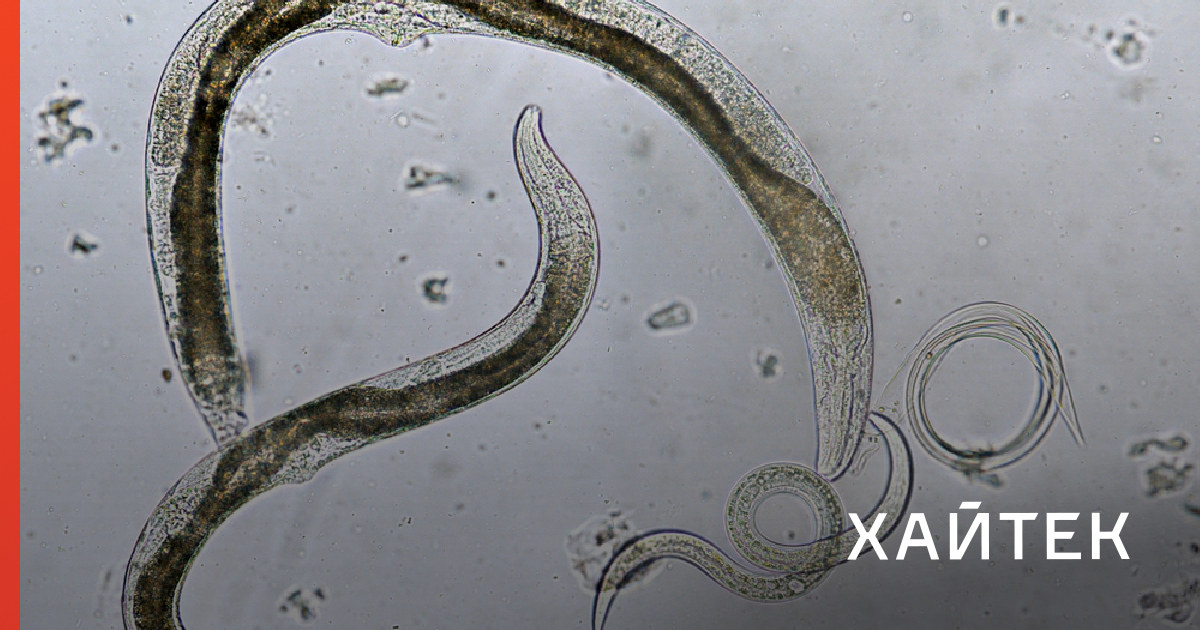 В посевах нематодоустойчивых сортов не должно быть примесей восприимчивых сортов, которые способны поддерживать популяцию нематоды в почве.
В посевах нематодоустойчивых сортов не должно быть примесей восприимчивых сортов, которые способны поддерживать популяцию нематоды в почве.
Семенной материал следует приобретать в государственных учреждениях, где проводятся проверки на заражение растений. Выращивать ранние и среднеранние сорта. Применение органических и минеральных удобрений. Уничтожать сорняки на участке, особенно пасленовые.
При обнаружении зараженных растений их желательно удалить с поля и сжечь. После работы на зараженном участке, чтобы не распространять нематоду, необходимо проводить очистку и дизинфекцию обуви, с/хозяйственного инвентаря.
Если вовремя выявить заражение нематодой, тогда и борьба с этим вредителем будет легче. Для этого необходимо регулярно проводить систематическое обследование посадок картофеля с отбором почвенных проб для лабораторной экспертизы, которую на территории Владимирской области осуществляет лаборатория экспертиз и обследований ФГБУ «Нижегородский референтный центр Россельхознадзора» по Владимирской области (специалист в Александровском районе: г. Александров, ул.Южный проезд, д. 10; тел. 8(49244) 3-21- 65).
Александров, ул.Южный проезд, д. 10; тел. 8(49244) 3-21- 65).
Нематоды | Почвенное биоразнообразие России
Skip to main content Почвенное биоразнообразие РоссииMain navigation
- Home
- Глобальные ресурсы
- Global Biodiversity Information Facility
- Global Soil Biodiversity Initiative
- iNaturalist
- Русскоязычный сайт о GBIF
- Инструменты
- R скрипт для стандартизации данных
- Таксономический справочник GBIF
- Координаторы
- Зайцев Андрей
- Иванова Наталья
- Потапов Антон
- Шашков Максим
- Миссия портала
- Наборы данных
- Collembola communities of Darwin Natural Reserve (Russia)
- Collembola of coniferous forests in the south of Arkhangelsk region
- Concrete fauna of Oribatida in the main ecoregions of European Part of Russia
- Earthworms population in old-growth taiga forests of Pechoro-Ilych State Nature Reserve
- Проекты
- Ресурсы по группам
- Коллемболы
- Tipulidae — Комары-долгоножки
- Дождевые черви
- Жужелицы
- Моллюски
- Муравьи
- Нематоды
- Пауки
- Home
https://www. wormbase.org
wormbase.org
Footer menu
- Contact
почвенных нематод — Phylum Nematoda
общее название: почвенные нематодынаучное название: Phylum Nematoda
Введение — Почвенные нематоды — Классификация — Привычки питания — Состав сообщества — Разложение — Избранные ссылки
Введение (наверх)
Нематоды встречаются почти во всех средах обитания, но их часто упускают из виду, поскольку большинство из них имеют микроскопические размеры. Например, квадратный ярд леса или сельскохозяйственной среды обитания может содержать несколько миллионов нематод.Многие виды являются узкоспециализированными паразитами позвоночных, включая человека, или насекомых и других беспозвоночных. Другие виды являются паразитами растений, некоторые из которых могут нанести экономический ущерб культурным растениям. Нематоды особенно многочисленны в морских, пресноводных и почвенных местообитаниях. Одно исследование в Колорадо показало, что нематоды потребляют примерно столько же травы, сколько колония луговых собачек.
Другие виды являются паразитами растений, некоторые из которых могут нанести экономический ущерб культурным растениям. Нематоды особенно многочисленны в морских, пресноводных и почвенных местообитаниях. Одно исследование в Колорадо показало, что нематоды потребляют примерно столько же травы, сколько колония луговых собачек.
Рисунок 1. Схема типичной фитопаразитической нематоды.Схема из Руководства по борьбе с нематодами во Флориде.
Почвенные нематоды (наверх)
Почва является прекрасной средой обитания для нематод, и в 100 см3 почвы может содержаться несколько тысяч из них. Из-за их важности для сельского хозяйства о нематодах, паразитирующих на растениях, известно гораздо больше, чем о других видах нематод, обитающих в почве. Большинство видов почвенных нематод не паразитируют на растениях, но способствуют разложению органического вещества. Эти нематоды часто называют свободноживущими нематодами. В почве также могут быть обнаружены ювенильные или другие стадии паразитов животных и насекомых. Хотя некоторые паразиты растений могут жить в корнях растений, большинство нематод обитает в тонкой пленке влаги вокруг частиц почвы. Ризосферная почва вокруг мелких корней растений и корневых волосков является особенно богатой средой обитания для многих видов нематод.
В почве также могут быть обнаружены ювенильные или другие стадии паразитов животных и насекомых. Хотя некоторые паразиты растений могут жить в корнях растений, большинство нематод обитает в тонкой пленке влаги вокруг частиц почвы. Ризосферная почва вокруг мелких корней растений и корневых волосков является особенно богатой средой обитания для многих видов нематод.
Классификация (В начало)
Нематоды — это круглые черви, принадлежащие к типу Nematoda. Различные авторитеты различают от 16 до 20 различных отрядов внутри этого типа.Только около 10 из этих отрядов регулярно встречаются в почве, а четыре отряда (Rhabditida, Tylenchida, Aphelenchida и Dorylaimida) особенно распространены в почве.
К середине 1980-х годов было описано более 15 000 видов и 2 200 родов нематод. Хотя нематоды, паразитирующие на растениях, относительно хорошо известны, большинство свободноживущих нематод изучено недостаточно. Поэтому существует высокая вероятность того, что в большинстве почвенных местообитаний будут содержаться неописанные виды свободноживущих нематод. Идентификация этих групп чрезвычайно сложна, и в мире есть всего несколько систематиков нематод, которые могут формально описать науке новые виды свободноживущих нематод. Поэтому большинство экологов-нематод относят почвенных нематод только к семейству или роду.
Идентификация этих групп чрезвычайно сложна, и в мире есть всего несколько систематиков нематод, которые могут формально описать науке новые виды свободноживущих нематод. Поэтому большинство экологов-нематод относят почвенных нематод только к семейству или роду.
Привычки питания (наверх)
Нематоды, обитающие в почве, также можно классифицировать в соответствии с их привычками питания. Эта классификация особенно полезна экологам для понимания положения нематод в пищевых сетях почвы.В большинстве почв обычно встречаются несколько важных пищевых групп нематод. Кроме того, в почве изредка встречаются альгифаги (питаются водорослями) и различные стадии паразитов насекомых и животных. Некоторые авторы называют группы питания нематод трофическими группами.
Травоядные . Это паразиты растений, которые относительно хорошо известны. В эту группу входят многие представители отряда Tylenchida, а также несколько родов отрядов Aphelenchida и Dorylaimida. Ротовой аппарат представляет собой игольчатый стилет, который используется для прокалывания клеток во время кормления. Эктопаразиты остаются в почве и питаются на поверхности корней. Эндопаразиты проникают в корни и могут жить и питаться внутри корня.
Ротовой аппарат представляет собой игольчатый стилет, который используется для прокалывания клеток во время кормления. Эктопаразиты остаются в почве и питаются на поверхности корней. Эндопаразиты проникают в корни и могут жить и питаться внутри корня.
Рисунок 2. Схема отделов головы травоядного (слева) и нематодного бактериофага (справа). У травоядных ротовой аппарат превращен в стилет для прокалывания растительных клеток. У бактериофагов рот или стома представляет собой полую трубку.
Бактериоядные . Многие виды свободноживущих нематод питаются только бактериями, которых в почве всегда чрезвычайно много. У этих нематод «рот» или стома представляет собой полую трубку для проглатывания бактерий. В эту группу входят многие представители отряда Rhabditida, а также несколько других отрядов, встречающихся реже. Эти нематоды полезны при разложении органических веществ.
Грибоядные . Эта группа нематод питается грибами и использует стилет для прокалывания гиф грибов. В эту группу входят многие представители отряда Aphelenchida. Как и бактериофаги, грибоядные играют очень важную роль в разложении.
В эту группу входят многие представители отряда Aphelenchida. Как и бактериофаги, грибоядные играют очень важную роль в разложении.
Хищники . Эти нематоды питаются другими почвенными нематодами и другими животными сопоставимого размера. Они без разбора питаются как растительными паразитами, так и свободноживущими нематодами. Один отряд нематод, Mononchida, является исключительно хищным, хотя несколько хищников также встречаются в Dorylaimida и некоторых других отрядах. По сравнению с другими группами нематод хищники встречаются нечасто, но некоторых из них можно встретить в большинстве почв.
Всеядные . Пищевые привычки большинства нематод в почве относительно специфичны. Например, бактериоядные питаются только бактериями и никогда не питаются корнями растений, а для паразитов растений верно обратное. Некоторые виды нематод могут питаться более чем одним типом пищевого материала и поэтому считаются всеядными. Например, некоторые нематоды могут поглощать грибковые споры, а также бактерии. Некоторые представители отряда Dorylaimida могут питаться грибами, водорослями и другими животными.
Некоторые представители отряда Dorylaimida могут питаться грибами, водорослями и другими животными.
Неизвестно . Поскольку свободноживущие нематоды мало изучены, пищевые привычки некоторых из них неизвестны. Микроскопические размеры этих животных представляют дополнительные трудности. Например, бывает очень трудно определить, питается ли нематода мертвыми клетками корня растения или грибами, растущими на поверхности клеток. Иногда нематода, проявляющая такое пищевое поведение, может быть классифицирована просто как корневой или растительный ассоциат.
Состав сообщества (наверх)
На одном пастбище в юго-центральной части Флориды травоядные составляли почти половину сообщества почвенных нематод, но также были широко представлены бактериоядные и грибоядные.Эта среда обитания давала много волокнистых корней в качестве источника пищи для травоядных, но другие группы нематод, особенно бактериоядные, могут преобладать в других средах обитания. Состав сообщества почвенных нематод зависит от имеющейся растительности, а также от типа почвы, времени года, уровня влажности почвы, количества органического вещества почвы и многих других факторов. Поскольку они реагируют на множество различных факторов, считается, что нематоды могут быть полезными биоиндикаторами состояния почвенной среды.
Поскольку они реагируют на множество различных факторов, считается, что нематоды могут быть полезными биоиндикаторами состояния почвенной среды.
Рисунок 3. Состав групп нематод в сообществе почвенных нематод.
Разложение (Вернуться к началу)
Свободноживущие нематоды очень важны и полезны для разложения органического материала и повторного использования питательных веществ в почве. Бактериофаги и грибоядные нематоды питаются не непосредственно органическим веществом почвы, а бактериями и грибами, которые разлагают органическое вещество.Присутствие и питание этих нематод ускоряет процесс разложения. Их питание перерабатывает минералы и другие питательные вещества из бактерий, грибов и других субстратов и возвращает их обратно. в почву, где они доступны для корней растений.
Избранные ссылки (наверх)
- Фрекман Д.В. 1982. Нематоды в почвенных экосистемах. Техасский университет Press, Остин, Техас.

- Ингам Р.Е., Детлинг Дж.К. 1984. Взаимодействие растений и травоядных в разнотравных прериях Северной Америки.III. Популяции почвенных нематод и корневая биомасса на колониях Cynomys ludovicianus и прилегающих неколонизированных участках. Экология 63: 307-313.
- МакСорли Р., Фредерик Дж.Дж. 2000. Кратковременное воздействие выпаса скота на сообщества нематод на пастбищах Флориды. Нематропика 30: 211-221.
- Поинар Г.О. мл. 1983. Естественная история нематод. Прентис-Холл, Энглвуд Клиффс, Нью-Джерси.
- Уоллес ХР. 1973. Экология нематод и болезни растений.Эдвард Арнольд, Лондон, Великобритания.
- Уортон Д.А. 1986. Функциональная биология нематод. Издательство Университета Джона Хопкинса. Балтимор, Мэриленд.
- Йейтс Г.В., Бонгерс Т., де Гёде Р.Г.М., Фрекман Д.В., Георгиева С.С. 1993. Привычки питания в семействах почвенных нематод и общий план для почвенных экологов. Журнал нематологии 25: 315-331.
Численность почвенных нематод и состав функциональных групп в глобальном масштабе
Департамент наук об окружающей среде, Институт интегративной биологии, ETH Zürich, Цюрих, Швейцария
Johan van den Hoogen, Stefan Geisen, Devin Routh & Thomas Ward Crowther
Департамент наземной экологии, Нидерландский институт экологии, Вагенинген, Нидерланды США
Howard Ferris
Экология животных, Билефельдский университет, Билефельд, Германия
Walter Traunspurger
Азиатская школа окружающей среды, Наньянский технологический университет, Сингапур, Сингапур
2 David A. Сингапур
Сингапур
2.Wardle
Группа почвенной биологии, Вагенингенский университет и исследования, Вагенинген, Нидерланды
Рон Г.М. де Гёде и Рэйчел Кример
Факультет биологии, Лаборатории эволюционной экологии, Музей Монте Л. Бина, Университет Бригама Янга, Прово , Юта, США
Байрон Дж. Адамс
Лаборатория исследования биоразнообразия нематод, Факультет зоологии, Мусульманский университет Алигарха, Алигарх, Индия
Васим Ахмад
Факультет биологии и Школа глобальной экологической устойчивости, Колорадо Университет, Форт-Коллинз, Колорадо, США
Уолтер С.Андриуцци и Дайана Х. Уолл
Школа наук о Земле и окружающей среде Манчестерского университета, Манчестер, Великобритания
Ричард Д. Барджетт
Институт зоологии, экологии суши, Кёльнский университет и Кластер передового опыта Науки о растениях (CEPLAS), Кельн, Германия
Майкл Бонковски и Т. А. Дуонг Нгуен
А. Дуонг Нгуен
Instituto de Ciencias de la Vid y del Vino, Университет Ла-Риоха-Гобьерно-де-Ла-Риоха, Логроньо, Испания
Ракель Кампос-Эррера
Кафедра фитопатологии, Институт биологических наук, Университет Бразилиа, Бразилиа, Бразилия
Juvenil E.Cares & Larissa de Brito Caixeta
Школа биологических наук, Институт глобальной продовольственной безопасности, Королевский университет Белфаста, Белфаст, Великобритания
Tancredi Caruso & Matthew Magilton
Лаборатория экологии почвы, Колледж ресурсов и наук об окружающей среде , Нанкинский сельскохозяйственный университет, Нанкин, Китай
Xiaoyun Chen
Центр молекулярной и экологической биологии Университета Миньо, Брага, Португалия
София Р.Коста
Empresa Brasileira de Pesquisa AgropeCuária (Embrapa), Centro de Pesquisa Agropecuária Do Tropico Semiárido, Petronolina, Бразилия
José Mauro da Cunha Castro
Зеландия Институт бизнес и технологий, Slagelse, Дания
Marie Dam
Институт Sénégalais de Recherches Agrocoles / CDH, Дакар, Сенегал
Djibril djigal
Instituto de Ciencias Agrarias, CSIC, Madrid, Испания
Miguel Escuer & Carmen Gutiérrez
Crop и почвенные системы исследовательской группы , SRUC, Эдинбург, Великобритания
Брайан С. Griffiths
Griffiths
Senckenberg Музей естественной истории Görlitz, Görlitz, Германия
Karin Hohberg
Институт биологии Карельского научно-исследовательского центра, Российская академия наук, Петрозаводск, Россия
Дарья Калинкина, Елизавета Матвеева и Анна Сущак
Департамент лесной экологии и управления, Шведский университет сельскохозяйственных наук, Умео, Швеция
Paul Kardol
Лаборатория функциональной экологии, Институт биологии, Невшательский университет, Невшатель, Швейцария
Alan Kergunteuil
Дж.Ф. Блюменбах Институт зоологии и антропологии Геттингенского университета, Геттинген, Германия
Валентина Крашевская и Стефан Шой
Институт биологии Коми научного центра УрО РАН, Сыктывкар, Россия
Алексей А. Кудрин
Эргунская лесостепная экотонная исследовательская станция Института прикладной экологии Китайской академии наук, Шэньян, Китай Защита, Претория, Южная Африка
Mariette Marais
Организация окружающей среды, Институциональный Nacional de Investigación Y Tecnología Agraria y Alimentaria, Мадрид, Испания
José Antonio Rodrígegez Martín
Лаборатория биотехнологии и валериации природных ресурсов, Факультет естественных наук Агадира, Университет Ибн Зохр, Агадир, Марокко
El Hassan Mayad
Кафедра биологических, геологических и экологических наук, Университет Катании, Катания, Италия
Christian Mulder
Кафедра патологии растений, Университет Небраски-Линкольн, Линкольн, NE, США
Christian Mulder
Питер Маллин, Томас О. Пауэрс и Кирстен Пауэрс
Пауэрс и Кирстен Пауэрс
Экологические науки, Институт Джеймса Хаттона, Данди, Великобритания
Рой Нейлсон
Институт экологии и биологических ресурсов, Вьетнамская академия наук и технологий, Ханой, Вьетнам
NDuongguy
Институт окружающей среды Хоксбери, Университет Западного Сиднея, Пенрит, Новый Южный Уэльс, Австралия
Уффе Н. Нильсен
Группа управления нематодами, Отдел прикладной энтомологии и зоологии, Центр сельскохозяйственных исследований Центрального региона, НАРО, Цукуба , Япония
Хироаки Окада
Институт устойчивого сельского хозяйства, Испанский национальный исследовательский совет, Кордова, Испания
Хуан Эмилио Паломарес Риус
Экологические процессы и биоразнообразие, Центр экологических исследований, Институт биологии Китая, Институт биологии Чэнду наук, Чэнду, Китай
Кайвен П. an
Институт изучения биоразнообразия и экосистем Болгарской академии наук, София, Болгария
Влада Пенева
Ландшафтная экология, Институт наземных экосистем, Отделение экологических систем, ETH Zürich, Цюрих, Швейцария
LOïC PelliSsier & Camille Pitteloud
Швейцарский федеральный научно-исследовательский институт WSL, Birmensdorf, Швейцария
Loïc Pellissier
Лаборатория нематологии, Департамент патологии завода, Универсада Федеральный де Лавара, Лавры, Бразилия
Julio Carlos Pereira Da Silva
Группа биосистематики, Вагенингенский университет, Вагенинген, Нидерланды
Каспер В. Quist
Quist
Лаборатория Nematology, Университет Вагенинген, Вагенинген, Нидерланды
Casper W. Quist & Wim Van Der Putten
Институт биологии, Университет Нейчателя, Нойчатель, Швейцария
Sergio Rasmann
Отдел средств защиты растений, Instituto Nacional de Investigacion y Tecnología Agraria y Alimentaria, Madrid, Spain
Sara Sánchez Moreno
Центр биоразнообразия и устойчивого землепользования, Университет Геттингена, Геттинген, Германия
Stefan Sche
Факультет биологических наук и наук об окружающей среде, Программа исследований экосистем и окружающей среды, Хельсинкский университет, Лахти, Финляндия
Хейкки Сетяля
A.Институт экологии и эволюции им. Н. Северцова РАН, Москва, Россия
Тиунов Алексей В.
Eco&Sols, Университет Монпелье, CIRAD, INRA, IRD, Montpellier SupAgro, Монпелье, Франция
Jean Trap & CECILE VILLENAVE
, Университет Au-Flakkebjerg, Орхус, Slagelse, Дания
Mette Vesergård
ELISOL Endrornement, Congénies, Франция
CECILE Villenave
Установка наукальных наук Сельское хозяйство, рыболовство и продовольствие, Мерелбеке, Бельгия
Lieven Waeyenberge
Центр экологии и гидрологии, Ланкастерский экологический центр, Ланкастер, Великобритания
Daniel G. Райт
Райт
Кафедра патологии растений и микробиологии, Тайваньский национальный университет, Тайпай, Тайвань и T.W.C. разработал и провел анализ данных. Дж.в.д.Х., Д.Р. и T.W.C. разработан и выполнен геопространственный анализ. J.v.d.H., S.G., H.F., R.G.M.d.G. и К.М. разработаны и выполнены расчеты биомассы. S.G., H.F., W.T., D.A.W., R.G.M.d.G., B.J.A., W.A., W.S.A., R.D.B., M.B., R.C.-H., J.E.C., T.C., X.C., SRC, RC, JMdCC, MD, LdBC, DD, ME, BSG, CG, KH, DK, PK, AK, GK, VK, AAK, QL, WL, M. Magilton, M. Marais, JARM, EM , EHM, CM, PM, RN, TADN, UNN, HO, JEPR, K. Pan, VP, LP, JCPdS, CP, TOP, K. Powers, CWQ, SR, SSM, SS, HS, AS, AVT, JT , WHvdP, MV, CV, LW, ГВС, RW, DGW и Ж.-и.Ю. внесенные данные. J.v.d.H., S.G. и T.W.C. написал первый черновик рукописи при участии Д.А.В. Все авторы участвовали в редактировании статьи.
Как нематоды помогают растениям и почве?
Newswise — 17 мая 2021 г. — у нематод обычно плохая репутация. Да, некоторые из этих крошечных существ могут причинять вред растениям и животным. Но мало что известно о непаразитических нематодах, которые выполняют множество полезных функций. Эшли Шоу из Орегонского университета исследует эту тему в блоге Soils Matter :
Но мало что известно о непаразитических нематодах, которые выполняют множество полезных функций. Эшли Шоу из Орегонского университета исследует эту тему в блоге Soils Matter :
В это может быть трудно поверить, но вы, возможно, никогда не видели самых распространенных животных на Земле: почвенных нематод! Они представляют восемьдесят процентов жизни животных по численности и живут почти в каждой среде обитания.Это трудолюбивые и важные организмы.
Почвенные нематоды, которых я изучаю, крошечные — обычно от 1/500 до 1/20 дюйма! (Но внутри кашалота живет нематода длиной почти тридцать футов.)
Действительно, некоторые из наиболее известных нематод являются паразитами. Существуют различные нематоды, паразитирующие на растениях и животных. Это означает, что они живут внутри или на растении или животном, не могут выжить без них и иногда убивают своего хозяина (а затем уходят).Но гораздо больше нематод являются свободноживущими. В почвах нематоды обитают в пленках воды, окружающих почвенные частицы. Как корневые паразиты растений, так и свободноживущие нематоды играют важную роль в здоровье растений и обратной связи растений с почвенным углеродом.
В почвах нематоды обитают в пленках воды, окружающих почвенные частицы. Как корневые паразиты растений, так и свободноживущие нематоды играют важную роль в здоровье растений и обратной связи растений с почвенным углеродом.
Невероятное разнообразие почвенных нематод существует на всех уровнях почвенной пищевой цепи. В основе пищевой паутины
одни питаются растениями и водорослями, другие – микробами (бактериями и грибами). На более высоких уровнях пищевой сети нематоды, являющиеся хищниками и всеядными, поедают других беспозвоночных, простейших и даже других нематод.В некоторых случаях «хищные» нематоды являются «хорошими парнями», контролирующими популяции паразитических нематод.
Эта пищевая сеть важна для здоровья растений и накопления углерода в почве. Например, питаясь бактериями и грибами, нематоды-микробы помогают возвращать азот в почву через свои отходы. Это делает азот снова доступным для использования растениями, улучшая их рост.
Нематоды также приносят в почвенную пищевую сеть другие виды. Некоторые бактерии выживают в кишечнике нематод и откладываются вместе с продуктами жизнедеятельности нематод.Еще больше проблем с внешней стороной тел нематод. Когда нематоды перемещаются в почве, они откладывают бактерии в новых местах, распространяя их. Бактерии могут способствовать и ускорять процесс разложения, возвращая углерод в почву для хранения.
Некоторые бактерии выживают в кишечнике нематод и откладываются вместе с продуктами жизнедеятельности нематод.Еще больше проблем с внешней стороной тел нематод. Когда нематоды перемещаются в почве, они откладывают бактерии в новых местах, распространяя их. Бактерии могут способствовать и ускорять процесс разложения, возвращая углерод в почву для хранения.
Но у большинства хороших вещей есть предел: при очень высокой популяции нематоды, питающиеся бактериями и грибами, могут сократить свою популяцию. Это может привести к снижению скорости разложения и оборота питательных веществ бактериями и грибками, что даже замедлит рост растений.
Нематоды, паразитирующие на растениях, поражают корни, используя прокалывающий инструмент во рту. Этот «стилет» прокалывает растительные клетки, чтобы высасывать их богатые углеродом соки. Некоторые нематоды выделяют химические вещества, которые вызывают повреждения или опухолевидные образования на корнях. Они истощают силы растения над землей и под землей.
В небольших популяциях нематоды, паразитирующие на растениях, могут стимулировать рост корней, но в больших количествах они разрушают корни, останавливают надземный рост и вызывают болезни. Более низкий рост растений (как корней, так и побегов) приводит к более низкому возврату органического материала в почву и, в конечном итоге, к более низкому содержанию углерода в почве.
В то время как видам нематод, ответственных за болезни растений, уделяется много внимания, гораздо меньше известно о непаразитической части сообщества почвенных нематод, которые играют в почве в основном полезную роль. Обеспечение баланса между полезными и паразитирующими на растениях группами нематод важно для здоровья растений и их вклада в почвенный углерод.
Как правило, нематоды, паразитирующие на корнях растений, наносят ущерб росту растений, а нематоды, питающиеся микробами, улучшают его, но важны и другие нематоды.Например, хищные нематоды играют важную роль в регулировании популяций нематод, паразитирующих на растениях, и нематод, питающихся микробами. Благодаря питанию они контролируют популяции паразитов растений и питающихся микробами нематод, оптимизируя рост растений.
Благодаря питанию они контролируют популяции паразитов растений и питающихся микробами нематод, оптимизируя рост растений.
Однако хищные нематоды также очень чувствительны к изменениям окружающей среды. Их популяция часто сокращается из-за нарушений почвы, таких как использование пестицидов, внесение удобрений, вспашка или уплотнение почвы. Ситуации, когда почва тщательно обрабатывается, часто приводят к очень низкой популяции хищников и более высокой популяции вредоносных групп.Хищники также чувствительны к изменениям дождя и температуры, что также может вызвать дисбаланс в сторону вредоносных групп.
Мое текущее исследование направлено на изучение того, как методы активного управления земельными ресурсами могут помочь повысить количество полезных групп нематод в почве за счет улучшения среды обитания в почве. Мы изучаем добавки компоста к пастбищам и изучаем, могут ли они улучшить накопление углерода в почве и рост растений.
Компост непосредственно обеспечивает питательные вещества и увеличивает удержание влаги в почве, улучшая рост растений. Компост также изменяет пищевую сеть почвы способами, которые не наблюдались при некоторых других обработках на наших исследовательских участках. Мы считаем, что органическое вещество почвы в компосте улучшает почвенную среду обитания для хищников, поддерживая длинные и сложные почвенные пищевые сети с многочисленными хищными нематодами, которые помогают контролировать популяции корневых паразитических нематод. В результате заболеваемость растений и корневой паразитизм снизились, что привело к увеличению роста растений и увеличению поступления углерода в корни при обработке компостом, что способствует накоплению углерода в почве.
Компост также изменяет пищевую сеть почвы способами, которые не наблюдались при некоторых других обработках на наших исследовательских участках. Мы считаем, что органическое вещество почвы в компосте улучшает почвенную среду обитания для хищников, поддерживая длинные и сложные почвенные пищевые сети с многочисленными хищными нематодами, которые помогают контролировать популяции корневых паразитических нематод. В результате заболеваемость растений и корневой паразитизм снизились, что привело к увеличению роста растений и увеличению поступления углерода в корни при обработке компостом, что способствует накоплению углерода в почве.
Для получения дополнительной информации о почвах следите за новостями SSSA в Facebook на https://www.facebook.com/SSSA.soils и в Twitter на SSSA_Soils. У SSSA есть информация о почвах на www.soils.org/discover-soils, для учителей – на www.soils4teachers.org, а для учащихся до 12 -го класса – на www.soils4kids.org.
Американское общество почвоведов (SSSA) – это прогрессивное международное научное общество, которое способствует обмену знаниями и практиками для сохранения почв во всем мире. SSSA, основанная в 1936 году в Мэдисоне, штат Висконсин, является профессиональным домом для более чем 6000 членов и более 1000 сертифицированных специалистов, занимающихся развитием области почвоведения. Общество предоставляет информацию о почвах в связи с растениеводством, качеством окружающей среды, устойчивостью экосистем, биоремедиацией, управлением отходами, переработкой и разумным землепользованием.
SSSA, основанная в 1936 году в Мэдисоне, штат Висконсин, является профессиональным домом для более чем 6000 членов и более 1000 сертифицированных специалистов, занимающихся развитием области почвоведения. Общество предоставляет информацию о почвах в связи с растениеводством, качеством окружающей среды, устойчивостью экосистем, биоремедиацией, управлением отходами, переработкой и разумным землепользованием.
Что такое нематоды? Эти крошечные черви могут помочь или навредить вашему саду
Д. Кучарски+К. Кучарская/Shutterstock
Хотя большинство из тысяч видов нематод на Земле не представляют опасности, некоторые из них вызывают заболевания у людей и других животных или нападают на живые растения и питаются ими.К счастью, есть способы удержать этих надоедливых вредителей от разрушения почвы в вашем саду.
Немногочисленные паразитические виды этих полупрозрачных несегментированных червей имеют длину около 1/50 дюйма и вызывают образование узлов или галлов на корнях, повреждение кончиков корней, чрезмерное ветвление корней, галлы на листьях, повреждения или отмирание тканей, а также скрученные, деформированные листья. Растения, наиболее часто поражаемые на корнях, включают помидоры черри, картофель, перец, салат, кукурузу и морковь. К растениям, которые повреждаются системой листьев и стеблей, относятся хризантемы, лук, рожь и люцерна.
Растения, наиболее часто поражаемые на корнях, включают помидоры черри, картофель, перец, салат, кукурузу и морковь. К растениям, которые повреждаются системой листьев и стеблей, относятся хризантемы, лук, рожь и люцерна.
Что такое нематоды?
Часто называемые круглыми червями, нематоды не имеют близкого родства с настоящими червями. Это многоклеточные насекомые с гладкими несегментированными телами. Виды нематод, которые питаются растениями, настолько малы, что вам нужен микроскоп, чтобы их увидеть. Взрослые особи часто выглядят длинными и стройными, хотя некоторые виды кажутся грушевидными. Эти растительные паразиты — , а не — те же круглые черви, что и филяриатозные нематоды, которые заражают человеческий организм, распространяют болезни и наносят ущерб иммунной системе.
Некоторые нематоды питаются внешней поверхностью растения, в то время как другие проникают в ткани. Наиболее распространенными виновниками являются нематоды, живущие в почве, но некоторые виды могут повреждать корни растений, стебли, листву и цветы.
Независимо от того, где они питаются, эти крошечные черви могут серьезно повредить урожай своими острыми ртами, прокалывая клеточные стенки. Настоящее повреждение происходит, когда нематода изо рта впрыскивает слюну в клетку, а затем высасывает содержимое клетки. Растение реагирует на паразитических червей вздутием, искривленным ростом и отмершими участками.Нематоды также могут переносить вирусы и бактериальные заболевания, вводить их в растения. Питательные раны, которые они делают, также обеспечивают легкий вход для бактерий и грибков.
Полезные нематоды, обогащающие почву, могут питаться разлагающимся материалом, насекомыми или другими нематодами.
Как выглядят нематоды
В отличие от большинства других болезнетворных организмов, нематоды, паразитирующие на растениях, редко проявляют характерные симптомы. Большинство симптомов, которые действительно появляются, расплывчаты и часто напоминают симптомы, вызванные другими факторами, такими как вирусы, дефицит питательных веществ или загрязнение воздуха. Нематоды, питающиеся над землей, могут вызывать скрученные и деформированные листья, стебли и цветы.
Нематоды, питающиеся над землей, могут вызывать скрученные и деформированные листья, стебли и цветы.
Гетти Изображений
Если нематоды питаются корнями, растение может выглядеть пожелтевшим, увядшим или низкорослым, а инфицированные пищевые культуры обычно дают плохой урожай. Если вы подозреваете, что черви повредили корни, осторожно поднимите одно из зараженных растений и промойте корни для облегчения осмотра. Если нематоды наносят ущерб, вы можете увидеть небольшие галлы или повреждения, поврежденные кончики корней, корневую гниль или чрезмерное ветвление корней.
Как они распространяются
Независимо от того, питаются ли они над землей или под землей, большинство нематод проводят по крайней мере часть своего жизненного цикла в почве. Хотя они не могут передвигаться очень далеко своим ходом, они могут свободно плавать в воде и быстрее передвигаться по влажной почве, поэтому рекомендуется поддерживать почву хорошо дренированной. Они также распространяются через все, что может нести частицы зараженной почвы, включая инструменты, обувь, животных и зараженные растения.
Они также распространяются через все, что может нести частицы зараженной почвы, включая инструменты, обувь, животных и зараженные растения.
А как насчет полезных нематод?
Полезные нематоды могут иметь длину от 1/25 дюйма до нескольких дюймов и тонкие, полупрозрачные, несегментированные тела.Их роли в саду различны. Некоторые из них обитают в почве и разлагают органические вещества, особенно в компостных кучах. Вы можете легко заметить этих разлагателей длиной 1/4 дюйма.
Эти типы на самом деле борются с различными видами вредителей, включая долгоносиков, чистокрылых мотыльков, совок, дерновых пауков, жуков и белых личинок. Нематоды атакуют и убивают этих насекомых, либо вводя смертельные бактерии, либо проникая в хозяина, паразитируя, а затем питаясь им.
При покупке и применении их в саду очень важно выбрать правильный вид, поскольку разные виды нематод эффективны против разных вредителей.Кроме того, нематодам требуются влажные, влажные условия и достаточно теплая почва, чтобы хорошо выполнять свою работу. Полейте все места применения до и после распространения нематод и тщательно следуйте инструкциям по применению.
Полейте все места применения до и после распространения нематод и тщательно следуйте инструкциям по применению.
Этот контент создается и поддерживается третьей стороной и импортируется на эту страницу, чтобы помочь пользователям указать свои адреса электронной почты. Вы можете найти дополнительную информацию об этом и подобном контенте на сайте piano.io.
границ | Воздействие корневых метаболитов на почвенные нематоды
Введение
Нематоды, паразитирующие на растениях, наносят серьезный ущерб и потери урожая широкому кругу сельскохозяйственных культур во всем мире, что, по оценкам, ежегодно приводит к потерям >80 миллиардов долларов (Nicol et al., 2011). Из-за их неблагоприятного воздействия на здоровье человека и окружающую среду химические нематоциды запрещены во всем мире, и поэтому существует острая необходимость в альтернативных и эффективных мерах контроля, а также в улучшенных методах ведения сельского хозяйства для сведения к минимуму потерь урожая.
Функционально нематоды, питающиеся корнями, классифицируются в соответствии с их способом питания. Все нематоды, питающиеся растениями, питаются растворимыми веществами клеток, втягиваемыми через стилет (у Tylenchida) или одонтостиль (у Dorylaimida), пронзающий клеточную стенку.Эпидермальные клетки и корневые волоски, вероятно, относительно безвредны, тогда как эктопаразиты и эндопаразиты считаются вредными. Эндопаразиты проникают в ткань корня и питаются внутри нее, тогда как эктопаразиты питаются исключительно с поверхности корня. После проникновения в корень сидячие самки эндопаразитов остаются на постоянном участке питания внутри корня до конца своей жизни, тогда как мигрирующие эндопаразиты сохраняют подвижность и перемещаются внутри и между корнями (Yeates et al., 1993).
Различные метаболиты растений в корнях и выделяемые из корней в ризосферу влияют на поведение, развитие, размножение и даже выживание нематод (Timper et al., 2006; Дандуранд и Кнудсен, 2016 г.; Ван и др. , 2018). Таким образом, некоторые метаболиты способствуют заражению растений паразитическими нематодами и их повреждению, в то время как другие прямо или косвенно уменьшают ущерб. Есть еще много механизмов, которые предстоит раскрыть, но для некоторых взаимодействий растений и нематод молекулярные механизмы хорошо изучены. Глубокое понимание химических взаимодействий между корнями растений и нематодами, паразитирующими на растениях, может стать основой для новых стратегий без пестицидов, направленных на снижение ущерба и потерь урожая от нематод, паразитирующих на растениях.
, 2018). Таким образом, некоторые метаболиты способствуют заражению растений паразитическими нематодами и их повреждению, в то время как другие прямо или косвенно уменьшают ущерб. Есть еще много механизмов, которые предстоит раскрыть, но для некоторых взаимодействий растений и нематод молекулярные механизмы хорошо изучены. Глубокое понимание химических взаимодействий между корнями растений и нематодами, паразитирующими на растениях, может стать основой для новых стратегий без пестицидов, направленных на снижение ущерба и потерь урожая от нематод, паразитирующих на растениях.
Например, с идентификацией нематоцидных корневых метаболитов программы селекции растений могут быть нацелены на создание сортов, производящих большое количество этих специфических метаболитов. Сельскохозяйственные методы также могут быть скорректированы для оптимизации борьбы с нематодами, паразитирующими на растениях, например. за счет выбора сортов культур с метаболическими профилями, подавляющими или репеллентными нематодами, за счет разумного севооборота, включающего покровные культуры, подавляющие нематоды, или невосприимчивые культуры, производящие дезинфицирующие метаболиты. Детальные знания о химически индуцированном вылуплении яиц нематод или поведении могут быть основой для целенаправленного вмешательства в идентификацию хозяина нематод и способность к заражению. Метаболиты растений могут даже способствовать эффективной колонизации ризосферы микроорганизмами, подавляющими нематоды (Elhady et al., 2018; Topalovic et al., 2019; Topalovic and Heuer, 2019). Следовательно, использование всего потенциала борьбы с нематодами, паразитирующими на растениях, с помощью микробов может зависеть от глубокого понимания химического влияния растений на трехсторонние взаимодействия между растениями, ризосферными микробиомами и нематодами.
Детальные знания о химически индуцированном вылуплении яиц нематод или поведении могут быть основой для целенаправленного вмешательства в идентификацию хозяина нематод и способность к заражению. Метаболиты растений могут даже способствовать эффективной колонизации ризосферы микроорганизмами, подавляющими нематоды (Elhady et al., 2018; Topalovic et al., 2019; Topalovic and Heuer, 2019). Следовательно, использование всего потенциала борьбы с нематодами, паразитирующими на растениях, с помощью микробов может зависеть от глубокого понимания химического влияния растений на трехсторонние взаимодействия между растениями, ризосферными микробиомами и нематодами.
Исследования метаболического воздействия корней растений на нематод, паразитирующих на растениях, продолжаются, но исследования в значительной степени все еще разрознены, а некоторые результаты противоречивы. Чтобы пролить ясность на поле, мы собрали современные знания об аспектах химических взаимодействий между живыми растениями и нематодами, паразитирующими на растениях, в агроэкосистемах. Мы стремимся тщательно проанализировать доступную литературу, чтобы оценить доказательства воздействия конкретных корневых метаболитов на нематод, паразитирующих на растениях, и дать представление о различных способах действия, оказываемых различными метаболитами корней на нематод, паразитирующих на растениях.Кроме того, мы хотим выявить пробелы в современном понимании и интерпретации химического воздействия растений на нематод, паразитирующих на растениях. Мы уделяем особое внимание взаимодействию между живыми корнями растений и нематодами и ссылаемся на несколько отличных обзоров, посвященных стратегиям биофумигации, основанным на включении покровных культур в почву (Fourie et al., 2016; Dutta et al., 2019). Кроме того, мы оценим, в какой степени метаболиты, воздействующие на нематод, паразитирующих на растениях, оказывают нежелательное воздействие на непаразитических нематод.
Мы стремимся тщательно проанализировать доступную литературу, чтобы оценить доказательства воздействия конкретных корневых метаболитов на нематод, паразитирующих на растениях, и дать представление о различных способах действия, оказываемых различными метаболитами корней на нематод, паразитирующих на растениях.Кроме того, мы хотим выявить пробелы в современном понимании и интерпретации химического воздействия растений на нематод, паразитирующих на растениях. Мы уделяем особое внимание взаимодействию между живыми корнями растений и нематодами и ссылаемся на несколько отличных обзоров, посвященных стратегиям биофумигации, основанным на включении покровных культур в почву (Fourie et al., 2016; Dutta et al., 2019). Кроме того, мы оценим, в какой степени метаболиты, воздействующие на нематод, паразитирующих на растениях, оказывают нежелательное воздействие на непаразитических нематод.
Корневые метаболиты
Около 5–20 % продуктов фотосинтеза высвобождаются в ризосферу через корневые экссудаты (Hütsch et al. , 2002; Marschner, 2012). Корни откладывают в ризосферу разнообразные метаболиты, многие из которых являются продуктами общих метаболических процессов растений. Отложение в ризосфере включает как активную секрецию, так и пассивное отложение метаболитов из-за осмотических и концентрационных различий между клеточными и почвенными растворами. Несколько исследований на модельных растениях выявили метаболиты, выбрасываемые в ризосферу.Например, 103 соединения были идентифицированы в корневом экссудате, собранном из выращиваемого гидропоникой растения Arabidopsis thaliana (Strehmel et al., 2014). Кроме того, корневой экссудат A. thaliana , выращенный на среде MS, был проанализирован на первичные метаболиты и идентифицировано 130 соединений (Chaparro et al., 2013). Кроме того, 289 предполагаемых вторичных метаболитов были количественно определены в корневых экссудатах Arabidopsis после воздействия салициловой кислотой, жасмоновой кислотой, хитозаном и двумя элиситорами клеточной стенки грибов (Walker et al.
, 2002; Marschner, 2012). Корни откладывают в ризосферу разнообразные метаболиты, многие из которых являются продуктами общих метаболических процессов растений. Отложение в ризосфере включает как активную секрецию, так и пассивное отложение метаболитов из-за осмотических и концентрационных различий между клеточными и почвенными растворами. Несколько исследований на модельных растениях выявили метаболиты, выбрасываемые в ризосферу.Например, 103 соединения были идентифицированы в корневом экссудате, собранном из выращиваемого гидропоникой растения Arabidopsis thaliana (Strehmel et al., 2014). Кроме того, корневой экссудат A. thaliana , выращенный на среде MS, был проанализирован на первичные метаболиты и идентифицировано 130 соединений (Chaparro et al., 2013). Кроме того, 289 предполагаемых вторичных метаболитов были количественно определены в корневых экссудатах Arabidopsis после воздействия салициловой кислотой, жасмоновой кислотой, хитозаном и двумя элиситорами клеточной стенки грибов (Walker et al. , 2003). Таким образом, химические профили Arabidopsis показывают, что большое количество метаболитов высвобождается в ризосферу в зависимости от условий роста.
, 2003). Таким образом, химические профили Arabidopsis показывают, что большое количество метаболитов высвобождается в ризосферу в зависимости от условий роста.
В этом обзоре мы сосредоточимся на влиянии специфических корневых метаболитов на нематод, начиная от паразитов растений и заканчивая почвенными свободноживущими нематодами. В таблицах 1–3 мы представляем корневые экссудаты и специфические корневые соединения, которые взаимодействуют с нематодами, паразитирующими на растениях, и описываем их влияние на таксоны нематод.
Таблица 1 Метаболиты корней, влияющие на передвижение нематод.
Таблица 2 Нематоцидные и ингибирующие нематоды корневые метаболиты.
Таблица 3 Метаболиты корней, влияющие на вылупление нематод.
Нематоды, паразитирующие на растениях Навигация
через Корневые химические сигналы Нематоды воспринимают окружающую среду с помощью хемосенсорного восприятия. Как правило, нематоды, паразитирующие на растениях, находят своего предпочтительного хозяина по сигналам корневого экссудата (Bird, 2004). Вокруг физиологически активных корней существует несколько химических градиентов, и вполне вероятно, что некоторые химические вещества представляют собой «аттрактанты дальнего действия», которые помогают нематодам мигрировать к занятым корнями объемам почвы, в то время как «аттрактанты ближнего действия» могут способствовать перемещению нематод к отдельным корням хозяина (Perry , 2005).Инфекционные личинки J2 галловых нематод Meloidogyne incognita и M. graminicola выбирают наиболее прямой путь к своему предпочтительному хозяину; однако они выбирают самый длинный путь к плохим хозяевам, что указывает на то, что определенные корневые метаболиты действуют как аттрактанты и репелленты соответственно и влияют на модели движения нематод, чтобы найти подходящего хозяина (Reynolds et al., 2011).
Как правило, нематоды, паразитирующие на растениях, находят своего предпочтительного хозяина по сигналам корневого экссудата (Bird, 2004). Вокруг физиологически активных корней существует несколько химических градиентов, и вполне вероятно, что некоторые химические вещества представляют собой «аттрактанты дальнего действия», которые помогают нематодам мигрировать к занятым корнями объемам почвы, в то время как «аттрактанты ближнего действия» могут способствовать перемещению нематод к отдельным корням хозяина (Perry , 2005).Инфекционные личинки J2 галловых нематод Meloidogyne incognita и M. graminicola выбирают наиболее прямой путь к своему предпочтительному хозяину; однако они выбирают самый длинный путь к плохим хозяевам, что указывает на то, что определенные корневые метаболиты действуют как аттрактанты и репелленты соответственно и влияют на модели движения нематод, чтобы найти подходящего хозяина (Reynolds et al., 2011).
Аттрактанты
В естественных условиях летучие соединения являются дальними сигналами для определения местонахождения личинок инфекционной галловой нематоды J2 подходящих хозяев. Более локально в корневой области водорастворимые химические вещества действуют как сигнальные сигналы (Curtis et al., 2009). Например, M. incognita способен воспринимать и использовать летучие органические соединения растений для определения местоположения хозяина (Kihika et al., 2017). Тем не менее, мы очень мало знаем об идентичности соединений, участвующих в привлечении нематод к хозяину, но недавние исследования выявили некоторые аттрактанты, вызываемые хозяином (таблица 1).
Более локально в корневой области водорастворимые химические вещества действуют как сигнальные сигналы (Curtis et al., 2009). Например, M. incognita способен воспринимать и использовать летучие органические соединения растений для определения местоположения хозяина (Kihika et al., 2017). Тем не менее, мы очень мало знаем об идентичности соединений, участвующих в привлечении нематод к хозяину, но недавние исследования выявили некоторые аттрактанты, вызываемые хозяином (таблица 1).
В летучих веществах, выделяемых корнями томата и шпинат, а три других (δ-3-карен, сабинен и метилсалицилат) были специфичны для летучих веществ корней томата.В биологических анализах 2-изопропил-3-метоксипиразин и тридекан привлекли личинок M. incognita J2 к корням шпината, но метилсалицилат был более привлекательным для J2, чем эти два соединения, и повторные эксперименты подтвердили, что метилсалицилат делает корни томатов более привлекательными. до M. incognita , чем корни шпината (Murungi et al. , 2018). Точно так же среди Capsicum annum , выделяемых корневыми летучими веществами, метилсалицилат проявлял самый сильный положительный хемотаксис инфекционного M.incognita J2, а затем пинен, лимонен, тридекан и 2-метокси-3-(1-метилпропил)пиразин (Kihika et al., 2017). Следовательно, два исследования (Kihika et al., 2017; Murungi et al., 2018) определяют метилсалицилат как наиболее важный летучий аттрактант M. incognita в исследованных пасленовых растениях. В биологическом анализе салициловая кислота привлекла M. incognita , а дофамин привлекла Radopholus similis (Wuyts et al., 2006).
, 2018). Точно так же среди Capsicum annum , выделяемых корневыми летучими веществами, метилсалицилат проявлял самый сильный положительный хемотаксис инфекционного M.incognita J2, а затем пинен, лимонен, тридекан и 2-метокси-3-(1-метилпропил)пиразин (Kihika et al., 2017). Следовательно, два исследования (Kihika et al., 2017; Murungi et al., 2018) определяют метилсалицилат как наиболее важный летучий аттрактант M. incognita в исследованных пасленовых растениях. В биологическом анализе салициловая кислота привлекла M. incognita , а дофамин привлекла Radopholus similis (Wuyts et al., 2006).
У нас ограниченная информация о соединениях, привлекающих цистообразующих нематод.Неизвестные летучие метаболиты в экссудатах корней картофеля привлекали личинок J2 картофельной цистообразующей нематоды Globodera pallida (Farnier et al., 2012). В биологическом анализе этефон, метилжасмонат, салициловая кислота, индолуксусная кислота и маннит показали положительный хемотаксис G. pallida J2 (Fleming et al., 2017). В тестах на нематодную инфекцию in vitro мутантов Arabidopsis с дефицитом сигнального пути стриголактона снижали привлечение и инвазию цистообразующей нематоды Heterodera schachtii по сравнению с растением дикого типа (Escudero Martinez et al., 2019).
pallida J2 (Fleming et al., 2017). В тестах на нематодную инфекцию in vitro мутантов Arabidopsis с дефицитом сигнального пути стриголактона снижали привлечение и инвазию цистообразующей нематоды Heterodera schachtii по сравнению с растением дикого типа (Escudero Martinez et al., 2019).
Репелленты
Идентификация соединений, отпугивающих нематод, паразитирующих на растениях (таблица 1), может стать важным шагом на пути к улучшению мер контроля. Молодь трех корневых галловых нематод второй стадии ( Meloidogyne hapla, M. javanica и M. incognita ) сильно привлекала кончики корней растений томата и бочкового клевера ( Medicago truncatula ). Однако корни мутантов с дефицитом сигналов этилена привлекали больше нематод, чем нематоды дикого типа (Cepulyte et al., 2018). Точно так же Arabidopsis , у которых был ингибирован синтез этилена, были более привлекательными для M. hapla , но корни мутантов, избыточно продуцирующих этилен, были менее привлекательными. Корни нечувствительного к этилену мутанта томата также были более привлекательными (Fudali et al., 2012). Эти примеры предполагают, что либо этилен, либо продукты чувствительных к этилену путей обычно отпугивают галловых нематод.
Корни нечувствительного к этилену мутанта томата также были более привлекательными (Fudali et al., 2012). Эти примеры предполагают, что либо этилен, либо продукты чувствительных к этилену путей обычно отпугивают галловых нематод.
Для цистообразующих нематод влияние этилена менее выражено. Корни сои и Arabidopsis , обработанные ингибитором синтеза этилена, больше привлекали соевых цистообразующих нематод ( Heterodera glycines ), и значительно больше нематод проникало в корни растений с ингибированным синтезом этилена.С другой стороны, нечувствительные к этилену мутантные корни образцов Arabidopsis были более привлекательными для H. glycines , чем дикий тип (Hu et al., 2017). Корни мутантов A. thaliana , избыточно продуцирующих этилен, были гиперчувствительны к свекольной нематоде ( Heterodera schachtii ), а нечувствительные к этилену мутанты были менее восприимчивы к H. schachtii (Wubben et al., 2001). Точно так же обработанные этиленом корни растений были более привлекательными для цистообразующих нематод сои и заражались гораздо быстрее, что приводило к более высокому уровню заражения (Kammerhofer et al. , 2015). Поэтому будущие исследования должны быть направлены на то, чтобы выяснить, регулируется ли отпугивание галловых нематод непосредственно этиленом или другими соединениями в чувствительных к этилену путях. Кроме того, дополнительная информация о влиянии этилена или этиленовых путей на цистообразующих нематод и другие таксоны паразитических нематод растений покажет, является ли этилен репеллентом широкого спектра действия.
, 2015). Поэтому будущие исследования должны быть направлены на то, чтобы выяснить, регулируется ли отпугивание галловых нематод непосредственно этиленом или другими соединениями в чувствительных к этилену путях. Кроме того, дополнительная информация о влиянии этилена или этиленовых путей на цистообразующих нематод и другие таксоны паразитических нематод растений покажет, является ли этилен репеллентом широкого спектра действия.
Тем не менее, было продемонстрировано, что большинство специфических соединений отталкивают только один таксон нематод у одного вида растений (таблица 1).Поэтому преждевременно делать общие выводы о том, какие репелленты наиболее эффективно отпугивают различные виды нематод, паразитирующих на растениях.
Некоторые метаболиты растений, которые эффективно отпугивали нематод, паразитирующих на растениях, в анализах без растений, могут стать объектами дальнейших исследований. Например, тимол, полученный из корня Capsicum annum (перец), отдельно или в сочетании с другими летучими веществами корня C. annum , индуцировал отрицательный хемотаксис как галловых, так и цистообразных и корневых нематод (Kihika et al., 2017). Некоторые флавоноиды также отпугивают нематод, паразитирующих на растениях, но для этих соединений эффект, по-видимому, больше зависит от вида. Например, флавоноиды кемпферол, кверцетин и мирицетин отталкивали Radopholus similis и Meloidogyne incognita , но не Pratylenchus penetrans. Другие флавоноиды, напр. лютеолин, даидзеин и генистеин отталкивали R. similis , но не оказывали влияния на M. incognita и P. penetrans (Wuyts et al., 2006).
annum , индуцировал отрицательный хемотаксис как галловых, так и цистообразных и корневых нематод (Kihika et al., 2017). Некоторые флавоноиды также отпугивают нематод, паразитирующих на растениях, но для этих соединений эффект, по-видимому, больше зависит от вида. Например, флавоноиды кемпферол, кверцетин и мирицетин отталкивали Radopholus similis и Meloidogyne incognita , но не Pratylenchus penetrans. Другие флавоноиды, напр. лютеолин, даидзеин и генистеин отталкивали R. similis , но не оказывали влияния на M. incognita и P. penetrans (Wuyts et al., 2006).
Нематоцидные/ингибирующие корневые соединения
Некоторые таксоны растений, напр. Бархатцы и Brassicaceae хорошо известны своим производством и высвобождением соединений, защищающих от нематод (таблица 2). Таким образом, включение растений с высоким содержанием нематоцидных или ингибирующих нематод соединений в системы возделывания сельскохозяйственных культур в качестве санитарной стратегии привлекло значительное внимание исследователей и также применяется на практике.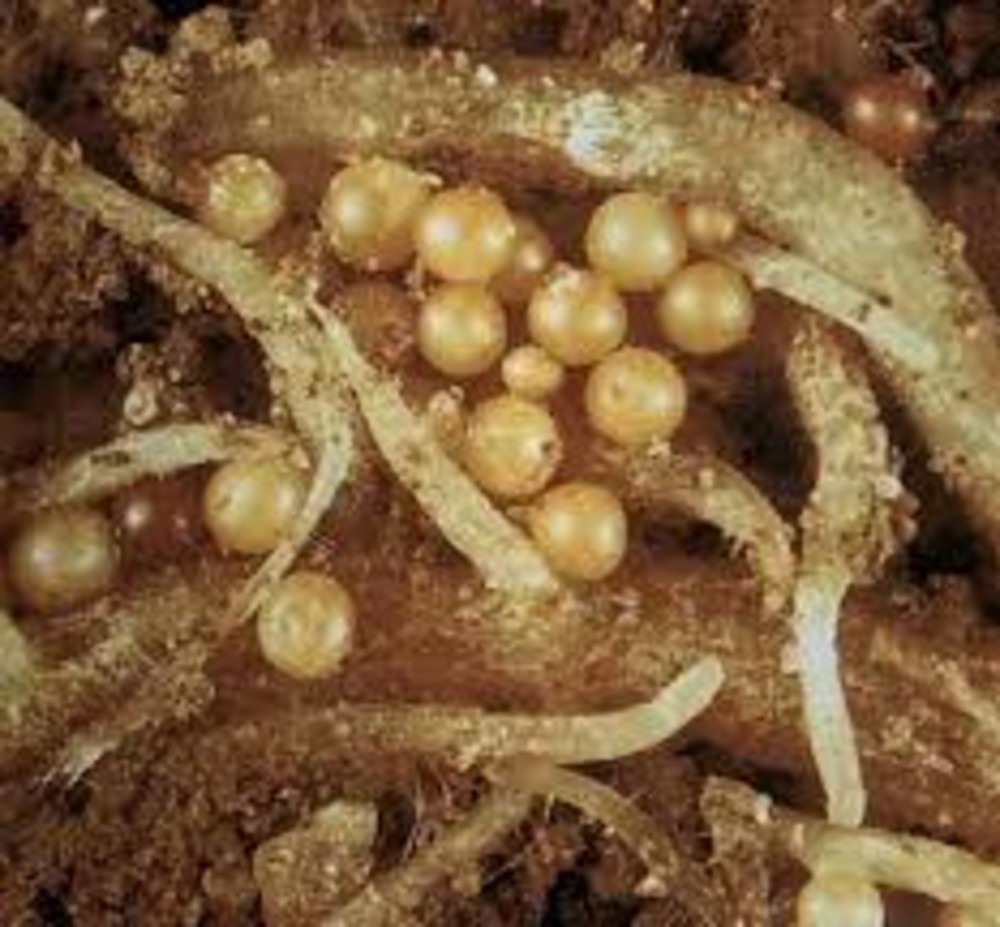 Кроме того, применение очищенных нематоцидных соединений растительного происхождения может быть эффективной стратегией борьбы с нематодами (Zanón et al., 2014).
Кроме того, применение очищенных нематоцидных соединений растительного происхождения может быть эффективной стратегией борьбы с нематодами (Zanón et al., 2014).
Виды Allium (например, лук-порей, лук и чеснок) содержат в своей цитоплазме предшественники сернистых аминокислот, которые при клеточной деградации расщепляются ферментом аллиназой до нового летучего органического соединения, диметилдисульфида (DMDS) (Haroutunian , 2015). Очищенный DMDS убил молодь J2 и уменьшил массу яиц и образование галлов M. incognita на корнях томата (Silva et al., 2018). DMDS в настоящее время доступен в качестве коммерческого биофумиганта, который при полевых испытаниях табака значительно уменьшил как M.incognita и Heterodera spp. заражения (Zanón et al., 2014). Точно так же DMDS также был эффективен против нематод цист картофеля и нематод корневых узлов на растениях картофеля и томатов (Coosemans, 2005), M. hapla и P. penetrans на клубнике (López-Aranda et al. , 2009), цист nematode ( H. carotae ) и M. incognita на моркови (Curto et al., 2014), на растениях томата (Myrta et al., 2018) и на арбузе (Leocata et al., 2014).
, 2009), цист nematode ( H. carotae ) и M. incognita на моркови (Curto et al., 2014), на растениях томата (Myrta et al., 2018) и на арбузе (Leocata et al., 2014).
Глюкозинолаты являются одной из наиболее часто изучаемых групп защитных вторичных метаболитов растений. При разрушении клеток, т.е. при поражении нематодами тиоглюкозидная связь гидролизуется эндогенными ферментами (мирозиназами), что приводит к образованию продуктов (например, изотиоцианата, тиоцианата, нитрила, эпитионитрила, оксазолидин-2-тиона), которые активны против травоядных и патогенов (Fahey et al. , 2001; Lambrix et al., 2007; Santolamazza-Carbone et al., 2014). Например, глюкозинаты, очищенные из Brassicaceae ( Brassica napus, B.rapa, B. carinata, Lepidium sativum, Raphanus sativus, и Sinapis alba ) не были токсичны для J2 цистообразующих нематод Heterodera schachtii в исходном виде, но продукты ферментативного гидролиза глюкозинолатов (изотиоцианата, синигрина, глюконапина, глюкотропеолин, дегидроэруцин) были смертельными для нематоды (Lazzeri et al. , 1993). Точно так же 11 глюкозинолатов и продукты их деградации не влияли на J2 галловой нематоды M. incognita , но продукты гидролиза мирозиназы (глюконастуртиин, глюкотропаолин, глюкоэруцин и синигрин) были высокотоксичными (Lazzeri et al., 2004). В других исследованиях также сообщается [], что глюкозинолаты смертельны для кистевидной нематоды Globodera rostochiensis только в присутствии мирозиназы (Buskov et al., 2002; Aires et al., 2009).
, 1993). Точно так же 11 глюкозинолатов и продукты их деградации не влияли на J2 галловой нематоды M. incognita , но продукты гидролиза мирозиназы (глюконастуртиин, глюкотропаолин, глюкоэруцин и синигрин) были высокотоксичными (Lazzeri et al., 2004). В других исследованиях также сообщается [], что глюкозинолаты смертельны для кистевидной нематоды Globodera rostochiensis только в присутствии мирозиназы (Buskov et al., 2002; Aires et al., 2009).
Пирролизидиновые алкалоиды (ПА) являются вторичными метаболитами у различных видов Asteraceae, Boraginaceae, Fabaceae, Convolvulaceae, Orchidaceae и Apocynaceae (Rizk, 1991; Trigo, 2011), особенно Crotalaria spp., Ageratum 900 и Senecio spp.(Асрес и др., 2004; Флорес и др., 2009; Тоден и др., 2009b; Stegelmeier, 2011). PA был признан токсичным для паразитических нематод растений Meloidogyne incognita , Heterodera schachtii и Pratylenchus penetrans (Thoden et al., 2009a). В биологическом анализе сообщалось, что PA [лолин (N-формиллолин)] в корневом экссудате овсяницы талловой является нематоцидным по отношению к J2 Pratylenchus scribneri (Bacetty et al., 2009). Аналогично, PA-содержащие Ageratum houstonianum и Senecio bicolor ингибировали M.hapla репродуцируется полностью, но M. hapla воспроизводятся на других ПА-содержащих видах (Thoden et al., 2009b; Vestergård, 2019). Таким образом, принятие растений, содержащих ПА, для борьбы с нематодами, паразитирующими на растениях, должно основываться на тщательном отборе подходящих видов.
В биологическом анализе сообщалось, что PA [лолин (N-формиллолин)] в корневом экссудате овсяницы талловой является нематоцидным по отношению к J2 Pratylenchus scribneri (Bacetty et al., 2009). Аналогично, PA-содержащие Ageratum houstonianum и Senecio bicolor ингибировали M.hapla репродуцируется полностью, но M. hapla воспроизводятся на других ПА-содержащих видах (Thoden et al., 2009b; Vestergård, 2019). Таким образом, принятие растений, содержащих ПА, для борьбы с нематодами, паразитирующими на растениях, должно основываться на тщательном отборе подходящих видов.
α-тертиенил, обычно содержащийся в ткани бархатцев ( Tagetes spp.), является одним из наиболее широко изученных нематоцидных соединений (Morallo-Rejesus and Decena, 1982; Nivsarkar et al., 2001; Hamaguchi et al., 2019). Хотя негативное воздействие Tagetes на нематод, паразитирующих на растениях, не всегда достигается в полевых условиях (Hooks et al., 2010), многие испытания продемонстрировали смягчающий потенциал Tagetes . Например, T. patula снижал плотность P. penetrans в течение трех лет подряд и уменьшал повреждение клубники от P. penetrans , и эти эффекты длились дольше, чем эффект химической фумигации почвы (Evenhuis et al., 2004). ).Аналогичным образом, совмещение растений томата с T. patula снижало размножение Meloidogyne и корневое галлообразование (Tringovska et al., 2015). В условиях in vivo корневой диффузант бархатцев ( Tagetes patula cv. Single gold) не влиял на характер отрождения, миграцию и проникновение M. chitwoodi и P. penetrans по сравнению с корнями томата, но уменьшал M. chitwoodi и полностью предотвратил размножение P. penetrans (Nježic et al., 2014). Другие биоактивные соединения Tagetes могут участвовать в подавлении нематод (Hooks et al., 2010), но нет сомнений в том, что α-тертиенил является сильнодействующим нематоцидом. Например, α-тертиенил показал 100% смертность Heterodera zeae при концентрации 0,125% через 24 часа (Faizi et al.
Например, T. patula снижал плотность P. penetrans в течение трех лет подряд и уменьшал повреждение клубники от P. penetrans , и эти эффекты длились дольше, чем эффект химической фумигации почвы (Evenhuis et al., 2004). ).Аналогичным образом, совмещение растений томата с T. patula снижало размножение Meloidogyne и корневое галлообразование (Tringovska et al., 2015). В условиях in vivo корневой диффузант бархатцев ( Tagetes patula cv. Single gold) не влиял на характер отрождения, миграцию и проникновение M. chitwoodi и P. penetrans по сравнению с корнями томата, но уменьшал M. chitwoodi и полностью предотвратил размножение P. penetrans (Nježic et al., 2014). Другие биоактивные соединения Tagetes могут участвовать в подавлении нематод (Hooks et al., 2010), но нет сомнений в том, что α-тертиенил является сильнодействующим нематоцидом. Например, α-тертиенил показал 100% смертность Heterodera zeae при концентрации 0,125% через 24 часа (Faizi et al. , 2011). Биологическая активность α-тертиенила значительно возрастает при воздействии ближнего ультрафиолета, что приводит к образованию биоцидного синглетного кислорода (Marles et al., 1992). Когда нематода проникает в корень, α-тертиенил активируется корневыми пероксидазами в отсутствие света (Gommers and Bakker, 1988), и поэтому предполагается, что α-тертиенил эффективен только в planta и не активен в растениях . почва (Hooks et al., 2010). Однако недавно сообщалось, что α-тертиенил на самом деле был нематотоксичен ex planta без фотоактивации (Hamaguchi et al., 2019).
, 2011). Биологическая активность α-тертиенила значительно возрастает при воздействии ближнего ультрафиолета, что приводит к образованию биоцидного синглетного кислорода (Marles et al., 1992). Когда нематода проникает в корень, α-тертиенил активируется корневыми пероксидазами в отсутствие света (Gommers and Bakker, 1988), и поэтому предполагается, что α-тертиенил эффективен только в planta и не активен в растениях . почва (Hooks et al., 2010). Однако недавно сообщалось, что α-тертиенил на самом деле был нематотоксичен ex planta без фотоактивации (Hamaguchi et al., 2019).
Бензоксазиноиды корневого экссудата, такие как 2,4-дигидрокси-7-метокси-2 H -1,4-бензоксазин-3(4 H )-он (DIMBOA), в основном продуцируемые во ржи и других злаках, были обнаружены токсичные против смешанных стадий американской кинжальной нематоды Xiphinema americanum (Zasada et al., 2005). Сорта ржи с более высокой концентрацией метоксизамещенных бензоксазиноидов в корнях имели самые низкие показатели — М. инкогнита яиц. Поэтому эти сорта были предложены для внесения в почву в качестве сидератов для защиты от галловых нематод (Zasada et al., 2007). В тепличных испытаниях почва, зараженная галловой нематодой Meloidogyne incognita , была обработана DIBOA (2,4-дигидрокси-2H-1,4-бензоксазин-3(4H)-он) в концентрациях от 1,1 до 18 мкг/г сухой почвы и производство яиц M. incognita в корнях огурца значительно снизилось при самой высокой концентрации (Meyer et al., 2009).
инкогнита яиц. Поэтому эти сорта были предложены для внесения в почву в качестве сидератов для защиты от галловых нематод (Zasada et al., 2007). В тепличных испытаниях почва, зараженная галловой нематодой Meloidogyne incognita , была обработана DIBOA (2,4-дигидрокси-2H-1,4-бензоксазин-3(4H)-он) в концентрациях от 1,1 до 18 мкг/г сухой почвы и производство яиц M. incognita в корнях огурца значительно снизилось при самой высокой концентрации (Meyer et al., 2009).
Защита растений, вызываемая нематодами, паразитирующими на растениях
Гормоны растений широко изучаются в качестве защитных стратегий против нематод, паразитирующих на растениях. Гормоны растений жасмоната (JA) играют ключевую роль в ранней защите растений от соевой нематоды Heterodera schachtii (Kammerhofer et al., 2015), галловой нематоды columbia Meloidogyne chitwoodi (Vieira dos Santos et al. , 2013), M. incognita (Fujimoto et al., 2011) и M.hapla (Gleason et al. , 2016), корневая нематода Pratylenchus ignorenus и цистообразующая нематода Heterodera avenae (Soriano et al., 2004). Жасмонат также взаимодействует с другими растительными гормонами и защищает растения от атак нематод. Например, растения, обработанные Ме-жасмонатом и этефоном (аналог этилена), сделали растения более защищенными от галловых нематод риса Meloidogyne graminicola по сравнению с необработанными растениями (Nahar et al., 2011).
, 2016), корневая нематода Pratylenchus ignorenus и цистообразующая нематода Heterodera avenae (Soriano et al., 2004). Жасмонат также взаимодействует с другими растительными гормонами и защищает растения от атак нематод. Например, растения, обработанные Ме-жасмонатом и этефоном (аналог этилена), сделали растения более защищенными от галловых нематод риса Meloidogyne graminicola по сравнению с необработанными растениями (Nahar et al., 2011).
Низкие уровни салициловой кислоты (СК) могут быть достаточными для базовой устойчивости и устойчивости Mi-1 к галловым нематодам (Bhattarai et al., 2008). Применение СК вызывало устойчивость к клеверной нематоде Heterodera trifolii у клевера белого (Kempster et al., 2001) и к Meloidgyne incognita (Molinari, 2016), M. javanica (Moslemi et al., 2016). и M. chitwoodi в растениях томатов (Vieira dos Santos et al., 2013). Абсцизовая кислота (АБК) играет сложную роль в защитных реакциях растений. В то время как он способствует устойчивости в одних взаимодействиях растений и патогенов, он повышает восприимчивость в других (Lim and Lee, 2015). Например, в одном исследовании репродукция галловой нематоды M. incognita на корнях картофеля была намного ниже у растений, обработанных АБК, по сравнению с контрольными растениями (Karimi, 1995), тогда как экзогенное применение АБК на растениях риса усиливало образование галлов. с помощью Meloidogyne graminicola и не нарушали развитие нематод (Kyndt et al., 2017). Точно так же экзогенное применение АБК снижало устойчивость растений томата к Meloidogyne javanica (Moosavi, 2017).Эти разнообразные реакции на применение АБК показывают сложную роль АБК в защите растений от нематод.
В то время как он способствует устойчивости в одних взаимодействиях растений и патогенов, он повышает восприимчивость в других (Lim and Lee, 2015). Например, в одном исследовании репродукция галловой нематоды M. incognita на корнях картофеля была намного ниже у растений, обработанных АБК, по сравнению с контрольными растениями (Karimi, 1995), тогда как экзогенное применение АБК на растениях риса усиливало образование галлов. с помощью Meloidogyne graminicola и не нарушали развитие нематод (Kyndt et al., 2017). Точно так же экзогенное применение АБК снижало устойчивость растений томата к Meloidogyne javanica (Moosavi, 2017).Эти разнообразные реакции на применение АБК показывают сложную роль АБК в защите растений от нематод.
Стимуляция/ингибирование вылупления
Цистовые нематоды (G lobodera spp. и Heterodera spp.), как правило, имеют очень узкий спектр хозяев, и, поскольку активные инвазионные ювенильные особи имеют лишь ограниченный запас энергии, они будут голодать и умрут в течение относительно короткого времени. короткий период без доступа к подходящему хосту. Тем не менее, инкапсулированные, спящие яйца остаются жизнеспособными от многих лет до десятилетий, и их вылупление и повторная активация вызываются специфическими для хозяина стимуляторами вылупления.Таким образом, применение стимуляторов вылупления в отсутствие растений-хозяев является многообещающей стратегией эффективного сокращения популяций цистообразующих нематод. Был идентифицирован ряд стимуляторов вылупления (таблица 3), например. пикролоновая кислота, индуцирующая вылупление Heterodera rostochiensis (Syn. Globodera rostochiensis ), H. glycines и H. tabacum (Clarke and Shepherd, 1966), glycinoeclepin, который индуцирует Масамунэ и соавт., 1987), а также соланоклепин, тиоцианат натрия, альфа-соланин и альфа-чаконин, которые вызывают вылупление G. pallida и G. rostochiensis (Schenk et al., 1999; Byrne et al., 2001).
короткий период без доступа к подходящему хосту. Тем не менее, инкапсулированные, спящие яйца остаются жизнеспособными от многих лет до десятилетий, и их вылупление и повторная активация вызываются специфическими для хозяина стимуляторами вылупления.Таким образом, применение стимуляторов вылупления в отсутствие растений-хозяев является многообещающей стратегией эффективного сокращения популяций цистообразующих нематод. Был идентифицирован ряд стимуляторов вылупления (таблица 3), например. пикролоновая кислота, индуцирующая вылупление Heterodera rostochiensis (Syn. Globodera rostochiensis ), H. glycines и H. tabacum (Clarke and Shepherd, 1966), glycinoeclepin, который индуцирует Масамунэ и соавт., 1987), а также соланоклепин, тиоцианат натрия, альфа-соланин и альфа-чаконин, которые вызывают вылупление G. pallida и G. rostochiensis (Schenk et al., 1999; Byrne et al., 2001).
Способы действия корневых метаболитов на нематод
Для большинства метаболитов растительного происхождения мы очень мало знаем об их молекулярном способе действия на нематоды.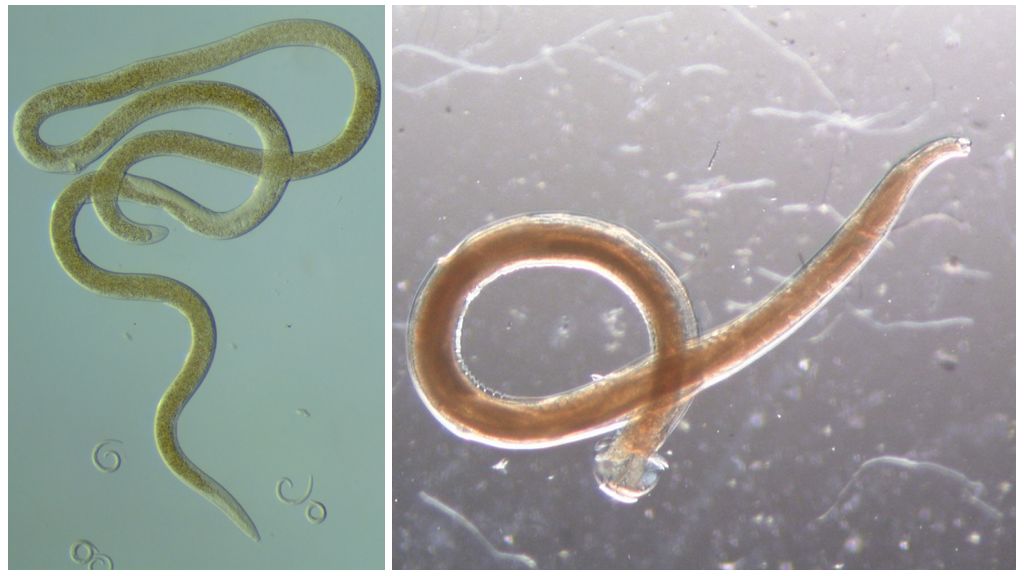 Здесь мы представляем примеры нескольких доступных исследований влияния метаболитов корней на экспрессию генов паразитических нематод растений.
Здесь мы представляем примеры нескольких доступных исследований влияния метаболитов корней на экспрессию генов паразитических нематод растений.
Экссудаты корней Arabidopsis thaliana , как было обнаружено, влияют на экспрессию генов у личинок M. incognita J2 до физического контакта и проникновения в корень. Было идентифицировано 63 гена-кандидата, которые по-разному экспрессировались в течение одного часа после воздействия экссудата, что свидетельствует о том, что корневые экссудаты вызывают изменения в экспрессии генов M. incognita (Teillet et al., 2013). Позже было продемонстрировано, что экссудаты корней томатов по-разному активировали четыре гена-кандидата паразитизма, а именно кальретикулин ( crt-1 ), β -1,4 эндоглюканазу-1 ( eng-1 ), катепсин L цистеиновую протеазу ( cpl). -1 ), белок, связывающий ретинол жирной кислоты ( far-1 ), и белок, подобный ядовитому аллергену ( vap-1 ) в препаразитарных Meloidogyne hispanica J2 (Duarte et al. , 2015). Однако идентичность соединений экссудата, вызывающих повышенную экспрессию этих генов, до сих пор неизвестна. Их раскрытие потенциально может привести к выведению сортов с низким уровнем активаторов генов паразитизма и, таким образом, к новым и улучшенным стратегиям борьбы с заражением галловыми нематодами.
, 2015). Однако идентичность соединений экссудата, вызывающих повышенную экспрессию этих генов, до сих пор неизвестна. Их раскрытие потенциально может привести к выведению сортов с низким уровнем активаторов генов паразитизма и, таким образом, к новым и улучшенным стратегиям борьбы с заражением галловыми нематодами.
Нематоды, паразитирующие на растениях, выделяют ферменты, разрушающие клеточную стенку растений, чтобы проникнуть в хозяина (Mitsumasu et al., 2015). Недавно были опубликованы первые доказательства того, что компоненты клеточной стенки растений и экссудаты корней хозяина регулируют экспрессию генов, кодирующих такие ферменты (Bell et al., 2019). Следовательно, Pratylenchus coffeae , обработанные целлюлозой, ксиланом или корневым экссудатом растений-хозяев, повышали экспрессию гена β-1,4-эндоглюканазы ( Pc-eng-1 ) или β-1,4-эндоксиланазы ( Pc-xyl ) соответственно. Исследование также подтвердило, что экспрессия этих двух генов важна для проникновения корней (Bell et al. , 2019).
, 2019).
Вылупление яиц цистообразующих нематод экссудатом хозяина, очевидно, связано с активацией экссудатом генов в спящих ювенильных цистообразующих нематодах.Например, в гидратированных цистах G. rostochiensis воздействие экссудата корней картофеля в течение 8 часов приводило к активизации гена, кодирующего трансмембранную металлопротеазу. Известно, что этот фермент активирует/инактивирует пептидные гормоны и может быть вовлечен в каскад событий, ведущих к вылуплению. Через 48 часов воздействия экссудата G . rostochiensis имел 278 дифференциально экспрессируемых генов, некоторые из которых являются известными эффекторными генами (Duceppe et al., 2017).
Эти исследования корневых узлов и корневых цист нематод демонстрируют, что корневые экссудаты влияют на экспрессию генов препаразитарной фазы/ранней фазы нематод, но какие компоненты экссудата участвуют в регуляции генов, еще предстоит раскрыть.
Мы очень мало знаем о молекулярных реакциях, вызываемых аттрактантами, репеллентами и токсинами нематод в теле нематод, но несколько исследований показывают, что корневые экссудаты регулируют экспрессию flp генов. Гены flp кодируют FMRFамидоподобные пептиды, разнообразную группу нейропептидов, участвующих в питании, репродуктивном и двигательном поведении нематод и, таким образом, играющих ключевую роль в хемотаксисе нематод. Например, низкие концентрации (0,5–2,00 мМ) лауриновой кислоты из корневых экссудатов ромашки ( Chrysanthemum coronarium ) привлекают Meloidogyne incognita , в то время как более высокая концентрация лауриновой кислоты (4,0 мМ) отпугивает нематод. Этот ответ, вероятно, вызван зависимой от концентрации лауриновой кислотой регуляцией экспрессии генов Mi-flp-18 (Dong et al., 2014). Кроме того, было обнаружено, что два других активных соединения, а именно пальмитиновая кислота и линолевая кислота, полученные из экссудата корня клещевины, отталкивают M. incognita и ингибируют экспрессию Mi-flp-18 и Mi-mpk-1 (митоген -активированная протеинкиназа) гены в зависимости от концентрации (Dong et al., 2018). Замалчивание генов G.
Гены flp кодируют FMRFамидоподобные пептиды, разнообразную группу нейропептидов, участвующих в питании, репродуктивном и двигательном поведении нематод и, таким образом, играющих ключевую роль в хемотаксисе нематод. Например, низкие концентрации (0,5–2,00 мМ) лауриновой кислоты из корневых экссудатов ромашки ( Chrysanthemum coronarium ) привлекают Meloidogyne incognita , в то время как более высокая концентрация лауриновой кислоты (4,0 мМ) отпугивает нематод. Этот ответ, вероятно, вызван зависимой от концентрации лауриновой кислотой регуляцией экспрессии генов Mi-flp-18 (Dong et al., 2014). Кроме того, было обнаружено, что два других активных соединения, а именно пальмитиновая кислота и линолевая кислота, полученные из экссудата корня клещевины, отталкивают M. incognita и ингибируют экспрессию Mi-flp-18 и Mi-mpk-1 (митоген -активированная протеинкиназа) гены в зависимости от концентрации (Dong et al., 2018). Замалчивание генов G. pallida flp ( Gp-flp-1, -6, -12, -14, или -18 ) привело к аберрантным поведенческим фенотипам, что еще раз подтверждает, что генов flp играют ключевую роль в двигательной функции и предполагает, что подавление гена flp может быть новой стратегией борьбы с паразитами растений (Kimber et al., 2007). Кроме того, для C. elegans потеря flp-1 и daf-10 также нарушала работу различных нейронов в нервных цепях (Buntschuh et al., 2018).
pallida flp ( Gp-flp-1, -6, -12, -14, или -18 ) привело к аберрантным поведенческим фенотипам, что еще раз подтверждает, что генов flp играют ключевую роль в двигательной функции и предполагает, что подавление гена flp может быть новой стратегией борьбы с паразитами растений (Kimber et al., 2007). Кроме того, для C. elegans потеря flp-1 и daf-10 также нарушала работу различных нейронов в нервных цепях (Buntschuh et al., 2018).
Поскольку химическое вещество, полученное из бархатцев, α-тертиенил, как ожидается, оказывает нематоцидное действие в почве, в недавнем исследовании изучалось молекулярное действие этого химического вещества без фотоактивации. Это исследование показало, что α-тертиенил нематоциден также в темноте, хотя эффект выше, когда соединение фотоактивировано. Кроме того, было установлено, что α-тертиенил является химическим веществом, вызывающим окислительный стресс, которое эффективно проникает в гиподерму нематод и подавляет экспрессию генов gst-4 (глутатион-S-трансфераза) и sod-1 (супероксиддисмутаза). Это приводит к ограничению продукции глутатион-S-трансферазы и супероксиддисмутазы, которые необходимы для защитных реакций от нематод (Hamaguchi et al., 2019).
Это приводит к ограничению продукции глутатион-S-трансферазы и супероксиддисмутазы, которые необходимы для защитных реакций от нематод (Hamaguchi et al., 2019).
Воздействие корневых метаболитов на нематод, не являющихся мишенями
Из-за их прямого воздействия на урожайность и качество сельскохозяйственных культур исследователи и специалисты-практики в области сельского хозяйства уделяют больше внимания паразитическим нематодам растений и лучше осведомлены о них, чем о многих видах нематод, обитающих в почве нематоды. Тем не менее нематоды, не являющиеся травоядными, выполняют функции, которые необходимы как для природных, так и для агроэкосистем.
Нематоды, питающиеся простейшими микроорганизмами, являются основными травоядными микробами в наземных экосистемах. Они регулируют размер, активность и функционирование бактериальных и грибковых популяций (Ingham et al., 1985; Rønn et al., 2012; Thakur and Geisen, 2019). Наиболее важным воздействием микробного выпаса нематод является усиление оборота и минерализации питательных веществ для растений, особенно азота, и, таким образом, стимуляция роста растений. Кроме того, поскольку таксоны бактерий различаются по качеству пищи и поедаемости нематодами (Bjørnlund et al., 2012) выпас нематод изменяет состав бактериальных сообществ (Xiao et al., 2014). Точно так же качество пищи для нематод, питающихся грибами, варьируется в зависимости от вида грибов (Chen and Ferris, 1999), и нематоды, питающиеся грибами, предпочтительно выбирают определенные виды грибов (Ruess et al., 2000). Таким образом, нематода, питающаяся корневыми микроорганизмами, вероятно, модулирует функциональные взаимодействия растений и микробиома.
Кроме того, поскольку таксоны бактерий различаются по качеству пищи и поедаемости нематодами (Bjørnlund et al., 2012) выпас нематод изменяет состав бактериальных сообществ (Xiao et al., 2014). Точно так же качество пищи для нематод, питающихся грибами, варьируется в зависимости от вида грибов (Chen and Ferris, 1999), и нематоды, питающиеся грибами, предпочтительно выбирают определенные виды грибов (Ruess et al., 2000). Таким образом, нематода, питающаяся корневыми микроорганизмами, вероятно, модулирует функциональные взаимодействия растений и микробиома.
Энтомопатогенные нематоды, то есть нематоды двух родов Heterorhabditis и Steinernema безвредны для растений и при некоторых обстоятельствах даже полезны для растений. Heterorhabditis spp. и Steinernema spp. тесно связаны с видами летальных для насекомых бактерий Protorhabdus и Xenorhabdus . Нематода проникает в полость тела восприимчивых личинок насекомых, где высвобождаются ассоциированные бактерии, размножаются и в конечном итоге убивают насекомое. Бактерии, растущие на трупе насекомого, затем служат пищей для нематод (Poinar, Grewal, 2012). При правильных условиях энтомопатогенные нематоды снижают численность личинок насекомых, наносящих вред корням (Toepfer et al., 2009). Поскольку нетравоядные нематоды выполняют множество центральных функций в наземных системах, уместно рассмотреть вопрос о том, снижают ли метаболиты растений, оказывающие неблагоприятное воздействие на паразитирующих на растениях нематод, выживаемость или продуктивность нематод, не являющихся мишенями.
Бактерии, растущие на трупе насекомого, затем служат пищей для нематод (Poinar, Grewal, 2012). При правильных условиях энтомопатогенные нематоды снижают численность личинок насекомых, наносящих вред корням (Toepfer et al., 2009). Поскольку нетравоядные нематоды выполняют множество центральных функций в наземных системах, уместно рассмотреть вопрос о том, снижают ли метаболиты растений, оказывающие неблагоприятное воздействие на паразитирующих на растениях нематод, выживаемость или продуктивность нематод, не являющихся мишенями.
Бархатцы ( Tagetes patula cv. Single Gold) корневые экссудаты не влияли на скорость миграции dauer молоди энтомопатогенной нематоды Steinernema fediae по отношению к личинкам Galleria mellonela .Даже воздействие диффузата корня календулы на молодь дауэра S. fediae в течение 24 часов приводило к более высокой скорости проникновения EPN по сравнению с почвенным фильтратом (Nježić et al., 2010). В биологическом анализе проросшие семена бархатцев привлекли Steinernema carpocapsae . Водные экстракты корней ноготков также не оказывали отрицательного влияния на инфекционность EPN, но синтетический α-тертиенил в концентрациях 20 и 40 частей на миллион значительно снижал количество нематод, заражающих насекомых-хозяев. Это указывает на то, что более высокие дозы этого химического вещества могут воздействовать на энтомопатогенных нематод (Kaya and Kanagy, 2010). Caenorhabditis elegans , нематода, питающаяся бактериями, была столь же чувствительна, как Meloidogyne incognita , и в 10 раз более чувствительна, чем Pratylenchus penetrans , к α-тертиенилу in vitro (Kyo et al., 1990; Hamagu). ).
Водные экстракты корней ноготков также не оказывали отрицательного влияния на инфекционность EPN, но синтетический α-тертиенил в концентрациях 20 и 40 частей на миллион значительно снижал количество нематод, заражающих насекомых-хозяев. Это указывает на то, что более высокие дозы этого химического вещества могут воздействовать на энтомопатогенных нематод (Kaya and Kanagy, 2010). Caenorhabditis elegans , нематода, питающаяся бактериями, была столь же чувствительна, как Meloidogyne incognita , и в 10 раз более чувствительна, чем Pratylenchus penetrans , к α-тертиенилу in vitro (Kyo et al., 1990; Hamagu). ).
В ходе полевых испытаний McSorley et al. (2009) и Wang et al. (2011b) оценили обилие в почве бактериальных, грибковых и всеядных/хищных нематод, а также панцирных клещей, хищных клещей и коллембол после посевов конопли ( Crotalaria juncea ) и покровных культур бархатцев и парового периода.Сравнение с обработкой паром не является идеальным для оценки потенциального негативного воздействия на нематод, питающихся микробами, и микроартропод-редуцентов, поскольку поступление органического субстрата для сапротрофных организмов, конечно, значительно ниже в паровых системах, чем в посевных.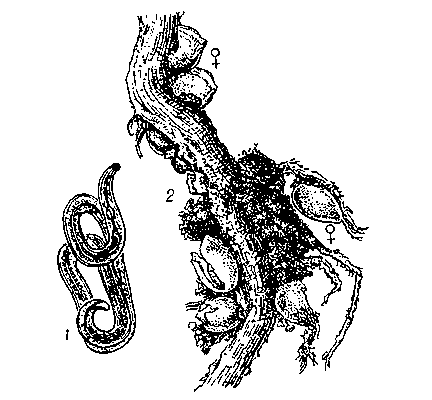 Поэтому неудивительно, что мульчирование солнечной коноплей временно увеличивает плотность бактериальных и грибковых нематод и микроартропод, питающихся по сравнению с паровой почвой. Плотность на участках, засеянных бархатцами, была такой же низкой, как и на участках под паром, во все времена отбора проб, и это могло, хотя и не однозначно, свидетельствовать о том, что бархатцы предотвращали рост нематод, питающихся микробами.Однако в других полевых экспериментах плотность нетравоядных нематод была выше на участках с бархатцами, чем на участках под паром, и сопоставима с почвой, обработанной компостом (Wang et al., 2011a; Korthals et al., 2014). Следовательно, результаты ограниченного числа полевых исследований и исследований in vitro нецелевого воздействия корня календулы на нетравоядных нематод варьируются от отрицательных эффектов до положительных эффектов. Необходимы строго контролируемые эксперименты, в том числе оценка реалистичных и сверхреалистичных концентраций метаболитов бархатцев на отдельных видах нематод и смешанных сообществах, чтобы сделать более твердые выводы об их значении для состава и функционирования нецелевых сообществ нематод на практике.
Поэтому неудивительно, что мульчирование солнечной коноплей временно увеличивает плотность бактериальных и грибковых нематод и микроартропод, питающихся по сравнению с паровой почвой. Плотность на участках, засеянных бархатцами, была такой же низкой, как и на участках под паром, во все времена отбора проб, и это могло, хотя и не однозначно, свидетельствовать о том, что бархатцы предотвращали рост нематод, питающихся микробами.Однако в других полевых экспериментах плотность нетравоядных нематод была выше на участках с бархатцами, чем на участках под паром, и сопоставима с почвой, обработанной компостом (Wang et al., 2011a; Korthals et al., 2014). Следовательно, результаты ограниченного числа полевых исследований и исследований in vitro нецелевого воздействия корня календулы на нетравоядных нематод варьируются от отрицательных эффектов до положительных эффектов. Необходимы строго контролируемые эксперименты, в том числе оценка реалистичных и сверхреалистичных концентраций метаболитов бархатцев на отдельных видах нематод и смешанных сообществах, чтобы сделать более твердые выводы об их значении для состава и функционирования нецелевых сообществ нематод на практике.
Корневой экссудат зеленого горошка ( Pisum sativum ) вызывал обратимое затишье у всех видов EPN ( Heterorhabditis bacteriophora , H. megidis , Steinernema feelliae0 S.pocaps
) протестированы car. и Однако этот ответ зависел от концентрации, и разбавленный корневой экссудат не вызывал покоя, но повышал активность EPN и инфекционность насекомых. Разбавленный корневой экссудат по-прежнему снижал активность соевой нематоды Heterodera glycines и галловой нематоды Meloidogyne incognita (Hiltpold et al., 2015). Чрезвычайно сложно определить, каким концентрациям корневого экссудата подвергаются нематоды in vivo , но авторы предполагают, что концентрации в ризосфере ниже уровня индукции покоя (Hiltpold et al., 2015).
Включение почвы Brassica Carinata Снижение корневого узла Nematode M. Chitwoodi , но также нарушила способность энтомопатогенных нематод S. Featiae и S. Riobrave для контроля крышек Colorado Colorado ( Leptinotarsa decemlineata ) . Это исследование раскрывает проблемы интеграции подходов биофумигации и биоконтроля в борьбу с нематодами, паразитирующими на растениях, и другими вредителями (Henderson et al., 2009). В долгосрочном полевом испытании включение биофумиганта Brassicaceae не уменьшило ни паразитарных растений, ни общей численности нематод, но, как и можно было ожидать из-за увеличения поступления мертвого растительного материала в почву, общая плотность нематод умеренно увеличилась (Korthals et al. , 2014). Аналогичным образом, биофумигантная желтая горчица не оказывала отрицательного воздействия на нематод, паразитирующих на растениях, и не оказывала незначительного положительного воздействия на микробное питание, всеядных и хищных нематод (Valdes et al., 2012).
Это исследование раскрывает проблемы интеграции подходов биофумигации и биоконтроля в борьбу с нематодами, паразитирующими на растениях, и другими вредителями (Henderson et al., 2009). В долгосрочном полевом испытании включение биофумиганта Brassicaceae не уменьшило ни паразитарных растений, ни общей численности нематод, но, как и можно было ожидать из-за увеличения поступления мертвого растительного материала в почву, общая плотность нематод умеренно увеличилась (Korthals et al. , 2014). Аналогичным образом, биофумигантная желтая горчица не оказывала отрицательного воздействия на нематод, паразитирующих на растениях, и не оказывала незначительного положительного воздействия на микробное питание, всеядных и хищных нематод (Valdes et al., 2012).
Тестирование эффектов четырех различных ПА, Thoden et al. (2009a) обнаружили, что подвижность бактериального питания Rhabditis sp. не изменился после 20-часового воздействия, но после недельного воздействия особенно один PA (монокроталин) уменьшил Rhabditis sp. мобильность. Кроме того, монокроталин отталкивал Rhabditis sp. Другой ПА (гелиотрин) восстанавливал Rhabditis sp. развитие и размножение. Нематода Phasmarhabditis hermaphrodita , заражающая слизней и улиток, полностью не подвергалась воздействию ПА (Thoden et al., 2009а; Тоден и др., 2009b). Кроме того, было показано, что использование видов Crotalaria , продуцирующих ПА, в качестве почвоулучшителя увеличивает численность свободноживущих нематод (Wang et al., 2007). Таким образом, в банановом саду солнечная конопля ( Crotalaria juncea L.) постоянно подавляла популяцию нематод, паразитирующих на растениях, Radopholus similis , в то же время поддерживая наибольшее количество полезных нематод (бактериоядных, грибоядных, всеядных и хищных видов) (Henmi и Марахатта, 2018).
мобильность. Кроме того, монокроталин отталкивал Rhabditis sp. Другой ПА (гелиотрин) восстанавливал Rhabditis sp. развитие и размножение. Нематода Phasmarhabditis hermaphrodita , заражающая слизней и улиток, полностью не подвергалась воздействию ПА (Thoden et al., 2009а; Тоден и др., 2009b). Кроме того, было показано, что использование видов Crotalaria , продуцирующих ПА, в качестве почвоулучшителя увеличивает численность свободноживущих нематод (Wang et al., 2007). Таким образом, в банановом саду солнечная конопля ( Crotalaria juncea L.) постоянно подавляла популяцию нематод, паразитирующих на растениях, Radopholus similis , в то же время поддерживая наибольшее количество полезных нематод (бактериоядных, грибоядных, всеядных и хищных видов) (Henmi и Марахатта, 2018).
Применение корневых метаболитов в борьбе с нематодами — проблемы и возможности
Было идентифицировано значительное количество биоактивных корневых соединений с документально подтвержденным влиянием на поведение, развитие или даже выживание (таблицы 1–3) нематод, паразитирующих на растениях. Потенциально эти знания могут быть применены для практического контроля или борьбы с нематодами, паразитирующими на растениях. Однако в большинстве случаев эффекты проверялись только на одном виде нематод, что вполне естественно, учитывая, что поле все еще находится на ранней стадии исследований.Поскольку соединения, воздействующие на более широкий спектр видов нематод, паразитирующих на растениях, и других организмов-вредителей, конечно, будут представлять наибольший интерес на практике, весьма уместны исследования воздействия на более широкий спектр таксонов нематод. С другой стороны, существует риск того, что метаболиты, активные в отношении широкого спектра нематод, паразитирующих на растениях, будут также оказывать нежелательное негативное воздействие на нематод, не являющихся паразитами. Учитывая важность микробоядных и энтомопатогенных нематод для круговорота питательных веществ и борьбы с травоядными насекомыми, соответственно, приоритет следует отдавать метаболитам, которые безвредны или даже полезны для нецелевых нематод.
Потенциально эти знания могут быть применены для практического контроля или борьбы с нематодами, паразитирующими на растениях. Однако в большинстве случаев эффекты проверялись только на одном виде нематод, что вполне естественно, учитывая, что поле все еще находится на ранней стадии исследований.Поскольку соединения, воздействующие на более широкий спектр видов нематод, паразитирующих на растениях, и других организмов-вредителей, конечно, будут представлять наибольший интерес на практике, весьма уместны исследования воздействия на более широкий спектр таксонов нематод. С другой стороны, существует риск того, что метаболиты, активные в отношении широкого спектра нематод, паразитирующих на растениях, будут также оказывать нежелательное негативное воздействие на нематод, не являющихся паразитами. Учитывая важность микробоядных и энтомопатогенных нематод для круговорота питательных веществ и борьбы с травоядными насекомыми, соответственно, приоритет следует отдавать метаболитам, которые безвредны или даже полезны для нецелевых нематод.
Способность идентифицировать и находить подходящих хозяев важна для всех нематод, паразитирующих на растениях. Таким образом, нематоды ориентируются и различаются между различными видами растений с помощью аттрактантов и репеллентов растительных метаболитов. Ряд метаболитов экссудата был идентифицирован как аттрактанты Meloidogyne incognita и несколько как аттрактанты Pratylenchus и видов цистообразующих нематод. Потенциально, совмещение восприимчивых культур с устойчивыми к нематодам или даже подавляющими нематоды растениями с высоким аттрактантом может уменьшить повреждение сельскохозяйственных культур (Dong et al., 2014). Поэтому мы предвидим, что непрерывные усилия, направленные на выявление и скрининг химических аттрактантов нематод, выделяемых видами растений с дополнительными желательными свойствами совмещения культур, будут способствовать улучшению борьбы с нематодами, паразитирующими на растениях.
Наоборот , идентификация довольно многих соединений, которые отпугивают несколько видов нематод, паразитирующих на растениях, конечно, представляет интерес.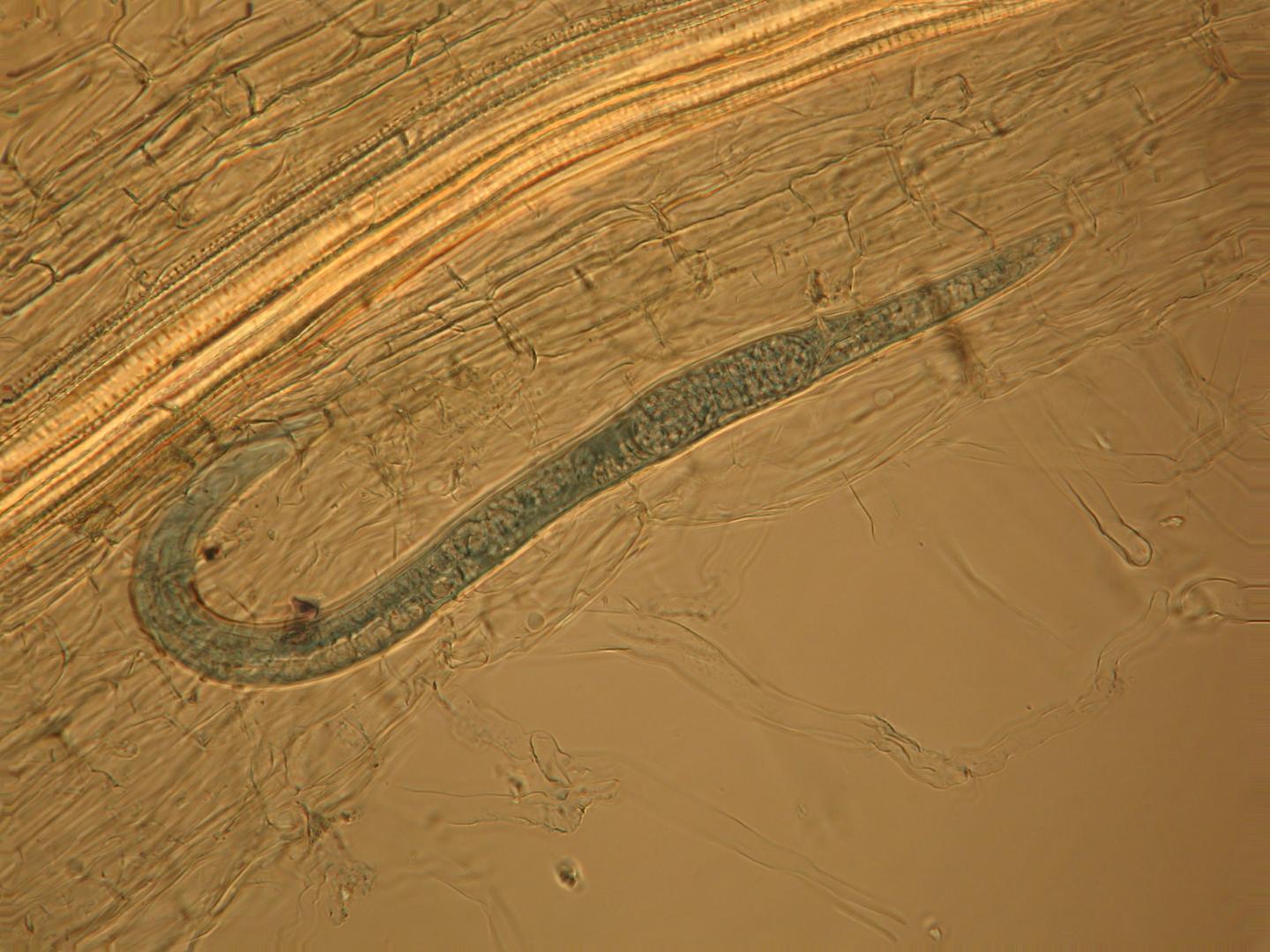 Селекция и разведение сортов растений, выделяющих высокие уровни репеллентов, может оказаться многообещающей стратегией снижения уровня заражения нематодами.С этой точки зрения интересно, что соединения-репелленты были идентифицированы в экономически важных растениях-хозяевах, где галловые нематоды представляют особую проблему, т.е. растения томата (Янг и др., 2016; Кирва и др., 2018). В садоводстве прививка становится обычной альтернативой длительной селекции на устойчивость к патогенам. Надземные части сортов с желательными признаками, напр. высокие урожаи и/или высокое качество плодов прививаются на подвоях близких родственников, устойчивых к определенным почвенным вредителям или патогенам, например.г. нематоды (Kawaide, 1985; Oka et al., 2004; Galatti et al., 2013; Thies et al., 2015). Мы предполагаем, что прививка на подвои, сильно репеллентные к нематодам, может быть аналогичным быстрым способом снижения потерь урожая, вызванных нематодами.
Селекция и разведение сортов растений, выделяющих высокие уровни репеллентов, может оказаться многообещающей стратегией снижения уровня заражения нематодами.С этой точки зрения интересно, что соединения-репелленты были идентифицированы в экономически важных растениях-хозяевах, где галловые нематоды представляют особую проблему, т.е. растения томата (Янг и др., 2016; Кирва и др., 2018). В садоводстве прививка становится обычной альтернативой длительной селекции на устойчивость к патогенам. Надземные части сортов с желательными признаками, напр. высокие урожаи и/или высокое качество плодов прививаются на подвоях близких родственников, устойчивых к определенным почвенным вредителям или патогенам, например.г. нематоды (Kawaide, 1985; Oka et al., 2004; Galatti et al., 2013; Thies et al., 2015). Мы предполагаем, что прививка на подвои, сильно репеллентные к нематодам, может быть аналогичным быстрым способом снижения потерь урожая, вызванных нематодами.
Список нематоцидных корневых соединений длинный, и опять же, многие из них были испытаны только в одном исследовании. Однако некоторые соединения, такие как лауриновые кислоты, ДМДС, пирролизидиновые алкалоиды (ПА), α-тертиенил и продукты катализируемого мирозиназой гидролиза глюкозинолатов, оказались смертельными как для корневых узлов, так и для цистообразующих нематод.Соответственно, растения с высоким уровнем некоторых из этих соединений включаются в стратегии борьбы с нематодами. На практике эффективность культур, производящих нематоцидные корневые метаболиты, может быть совершенно непредсказуемой. Например, катализируемый мирозиназой гидролиз глюкозинолатов должен индуцироваться разрушением клеточной стенки, таким как нападение насекомых или нематод, или во время деградации мертвых частей растения. Кроме того, активность мирозиназы зависит от температуры (Ploeg and Stapleton, 2001; Lopez-Perez et al., 2005). Таким образом, достаточность вызванной продукции и выброса в почву ризосферы для значительного сокращения популяций нематод, паразитирующих на растениях, может сильно зависеть от контекста. Применение очищенного DMDS, нематоцида, полученного после ферментативного превращения предшественников сернистых аминокислот в видов Allium (Zanón et al.
Однако некоторые соединения, такие как лауриновые кислоты, ДМДС, пирролизидиновые алкалоиды (ПА), α-тертиенил и продукты катализируемого мирозиназой гидролиза глюкозинолатов, оказались смертельными как для корневых узлов, так и для цистообразующих нематод.Соответственно, растения с высоким уровнем некоторых из этих соединений включаются в стратегии борьбы с нематодами. На практике эффективность культур, производящих нематоцидные корневые метаболиты, может быть совершенно непредсказуемой. Например, катализируемый мирозиназой гидролиз глюкозинолатов должен индуцироваться разрушением клеточной стенки, таким как нападение насекомых или нематод, или во время деградации мертвых частей растения. Кроме того, активность мирозиназы зависит от температуры (Ploeg and Stapleton, 2001; Lopez-Perez et al., 2005). Таким образом, достаточность вызванной продукции и выброса в почву ризосферы для значительного сокращения популяций нематод, паразитирующих на растениях, может сильно зависеть от контекста. Применение очищенного DMDS, нематоцида, полученного после ферментативного превращения предшественников сернистых аминокислот в видов Allium (Zanón et al. , 2014; Haroutunian, 2015), демонстрирует, что лучший и более надежный контроль над нематодами может быть достигнут путем прямого применения биоактивный фитохим.
, 2014; Haroutunian, 2015), демонстрирует, что лучший и более надежный контроль над нематодами может быть достигнут путем прямого применения биоактивный фитохим.
Длительное время сохранения инцистированных яиц представляет особую проблему для борьбы с цистообразующими нематодами. Насколько нам известно, возможность применения стимуляторов вылупления для контроля или искоренения цистообразующих нематод еще предстоит изучить. Однако включение стимулирующих выклев растений-нехозяев в схемы севооборотов или даже прекращение использования культур-хозяев до размножения цистообразующих нематод является способом снижения плотности персистентных цист в зараженной почве (Scholte, 2000; Danduran and Knudsen, 2016).Полевые испытания, в которых Solanum sisymbriifolium (паслен липкий) вызывают вылупление Globodera , которые не могут завершить свой жизненный цикл на S. sisymbriifolium , демонстрируют, что индукция вылупления в отсутствие восприимчивых хозяев эффективно снижает плотность отдыхающих , жизнеспособные цисты в почве (Scholte and Vos, 2000).
Для большинства специфических корневых соединений их действие на нематод было продемонстрировано in vitro (таблицы 1–3). Эксперименты in vitro, очевидно, необходимы для получения убедительных доказательств действия соединений-кандидатов. Между тем, экстраполяция результатов, полученных in vitro на ризосферу и в условиях planta , не является простой задачей. Для многих соединений информация об их концентрациях в корнях и, в частности, в ризосферной почве скудна, а концентрация в ризосфере легко может быть в 1000 раз ниже, чем в корнях (Kudjordjie et al., 2019). Таким образом, мы подчеркиваем, что эффекты, обнаруженные при низких концентрациях, то есть мкМ, ppm или ниже, в анализах, охватывающих градиент концентрации, с большей вероятностью отражают механизмы, актуальные в реальных условиях.
Очевидно, что физико-химическая сложность почвенных систем, будь то в теплице или в поле, может изменить или полностью устранить последствия воздействия in vitro . Например, удобрение NPK снижает концентрацию PA в Senecio spp.корни (Hol, 2011), предполагая, что растения регулируют производство защитных соединений в зависимости от доступности питательных веществ. Другие абиотические факторы, такие как влажность и структура почвы, модулируют диффузию и, таким образом, распределение летучих соединений растительного происхождения в почвенной матрице (Hiltpold and Turlings, 2008), и поэтому реакция нематод на летучие сигналы, вероятно, также зависит от этих факторов. Следовательно, будет интересно увидеть результаты более исследований in vivo , т.е. оценка воздействия мутантных линий растений, у которых нарушены или чрезмерно выражены определенные метаболические пути в различных типах почв и различных абиотических условиях.
Например, удобрение NPK снижает концентрацию PA в Senecio spp.корни (Hol, 2011), предполагая, что растения регулируют производство защитных соединений в зависимости от доступности питательных веществ. Другие абиотические факторы, такие как влажность и структура почвы, модулируют диффузию и, таким образом, распределение летучих соединений растительного происхождения в почвенной матрице (Hiltpold and Turlings, 2008), и поэтому реакция нематод на летучие сигналы, вероятно, также зависит от этих факторов. Следовательно, будет интересно увидеть результаты более исследований in vivo , т.е. оценка воздействия мутантных линий растений, у которых нарушены или чрезмерно выражены определенные метаболические пути в различных типах почв и различных абиотических условиях.
Кроме того, производство многих соединений, которые мешают работе нематод, вызывается присутствием других надземных или подземных травоядных. Например, корневые экссудаты растений картофеля, подвергшихся воздействию тли Myzus persicae , снижали вылупление яиц и препятствовали экспрессии гена цисты у Globodera pallida (Hoysted et al. , 2018). Ясно, что когда химическая защита растений под землей зависит от взаимодействия растений с надземными организмами, становится трудно прогнозировать и полагаться на эффективность подземной защиты на практике.Более того, симбионты, по-видимому, также регулируют производство защитных соединений; например арбускулярные микоризные грибы снижали концентрацию бензоксазиноидов в корнях пшеницы, в то время как заражение корней Pratylenchus ignorenus было на 47–117% выше у микоризных растений, чем у немикоризных (Frew et al., 2018).
, 2018). Ясно, что когда химическая защита растений под землей зависит от взаимодействия растений с надземными организмами, становится трудно прогнозировать и полагаться на эффективность подземной защиты на практике.Более того, симбионты, по-видимому, также регулируют производство защитных соединений; например арбускулярные микоризные грибы снижали концентрацию бензоксазиноидов в корнях пшеницы, в то время как заражение корней Pratylenchus ignorenus было на 47–117% выше у микоризных растений, чем у немикоризных (Frew et al., 2018).
Биологическая сложность почвенных систем огромна, поэтому корневые метаболиты взаимодействуют с множеством различных почвенных организмов. Следовательно, большинство сигнальных и нематоцидных соединений, упомянутых в этом обзоре, воздействуют и на другие патогены.Например, метилсалицилат и салициловые кислоты играют несколько ролей в защите растений от широкого спектра патогенов (Hammerbacher et al., 2019; Maruri-Lopez et al., 2019), а DIMBOA и другие бензоксазиноиды также обладают антагонистическим действием по отношению к насекомым-вредителям и грибковые патогены (Fomsgaard et al. , 2004). Растения, производящие соединения, антагонистические по отношению к многочисленным вредителям и патогенам, могут быть особенно ценными компонентами в стратегиях санитарии.
, 2004). Растения, производящие соединения, антагонистические по отношению к многочисленным вредителям и патогенам, могут быть особенно ценными компонентами в стратегиях санитарии.
Неизбежный микробный оборот выделяемых метаболитов ставит под сомнение экстраполяцию результатов исследований in vitro на почвенные условия.Например, несмотря на то, что DIBOA оказался эффективным нематоцидом в водных анализах, быстрый микробный оборот и возможная абсорбция частицами почвы уменьшали нематоцидный эффект в почве (Meyer et al., 2009). Следовательно, микробная деградация может инактивировать или снижать активность биоцидных соединений в почве.
Еще больше усложняет ситуацию то, что действие некоторых химических веществ растительного происхождения различается в зависимости от вида нематод. Этилен обычно отпугивает галловых нематод, тогда как по крайней мере некоторые цистообразные нематоды привлекаются этиленом.Таким образом, на полях, зараженных обоими типами нематод, этилен может, с одной стороны, снизить заражение галловыми нематодами, а с другой стороны, освободить галловых нематод от конкуренции со стороны галловых нематод. Очевидно, что большинство исследований воздействия корневых метаболитов на нематод было сосредоточено на нематодах, которые наносят наибольший ущерб экономически важным сельскохозяйственным культурам; т. е. галловые нематоды, в частности M. incognita , цистообразующие нематоды и корневые нематоды (Jones et al., 2013), и мы очень мало знаем о воздействии корневых метаболитов на эктопаразитических нематод.Эндо- и эктопаразитические виды нематод могут конкурировать и доминировать в различных условиях окружающей среды (Brinkman et al., 2004; Vestergård et al., 2004), и поэтому стоит подумать, могут ли стратегии, нацеленные на эндопаразитов, увеличить популяции и ущерб посевам, наносимый эктопаразитарными паразитами. нематоды.
Очевидно, что большинство исследований воздействия корневых метаболитов на нематод было сосредоточено на нематодах, которые наносят наибольший ущерб экономически важным сельскохозяйственным культурам; т. е. галловые нематоды, в частности M. incognita , цистообразующие нематоды и корневые нематоды (Jones et al., 2013), и мы очень мало знаем о воздействии корневых метаболитов на эктопаразитических нематод.Эндо- и эктопаразитические виды нематод могут конкурировать и доминировать в различных условиях окружающей среды (Brinkman et al., 2004; Vestergård et al., 2004), и поэтому стоит подумать, могут ли стратегии, нацеленные на эндопаразитов, увеличить популяции и ущерб посевам, наносимый эктопаразитарными паразитами. нематоды.
Заключительные замечания
В связи с нынешним и прошлым изъятием химических нематицидов понимание химического воздействия корней на нематод, паразитирующих на растениях, является важным вкладом в альтернативные стратегии борьбы с нематодами, паразитирующими на растениях. В этом обзоре показано, что широкий спектр корневых химических веществ для ряда таксонов растений потенциально участвует в определении местоположения хозяина нематоды, вылуплении яиц и выживании. Некоторые из этих идей уже используются на практике, т.е. использование нематоцидных растений или применение очищенных нематоцидов растительного происхождения, а также использование растений, стимулирующих вылупление яиц, для борьбы с цистообразующими нематодами. Тем не менее, мы считаем, что есть возможности для более эффективного использования корневых метаболитов для борьбы с нематодами.Многие растительные метаболиты, биоактивность которых явно доказана в строго контролируемых лабораторных условиях, менее надежны в полевых условиях. Несоответствие между эффективностью in vitro и in vivo может отражать то, что соединения тестировались в нереалистичных концентрациях в лаборатории, что физико-химические факторы почвы снижают их активность, что они инактивируются в результате быстрой микробной деградации и т.
В этом обзоре показано, что широкий спектр корневых химических веществ для ряда таксонов растений потенциально участвует в определении местоположения хозяина нематоды, вылуплении яиц и выживании. Некоторые из этих идей уже используются на практике, т.е. использование нематоцидных растений или применение очищенных нематоцидов растительного происхождения, а также использование растений, стимулирующих вылупление яиц, для борьбы с цистообразующими нематодами. Тем не менее, мы считаем, что есть возможности для более эффективного использования корневых метаболитов для борьбы с нематодами.Многие растительные метаболиты, биоактивность которых явно доказана в строго контролируемых лабораторных условиях, менее надежны в полевых условиях. Несоответствие между эффективностью in vitro и in vivo может отражать то, что соединения тестировались в нереалистичных концентрациях в лаборатории, что физико-химические факторы почвы снижают их активность, что они инактивируются в результате быстрой микробной деградации и т. д. Поэтому существует необходимость в экспериментальные исследования, чтобы преодолеть разрыв между строго контролируемыми лабораторными экспериментами и реалистичными полевыми условиями.Такие эксперименты, т.е. Эксперименты с мезокосмом растений и почвы должны быть направлены на выяснение судьбы и активности ключевых метаболитов в ризосфере в зависимости, например, от текстура почвы, структура, pH, температура и микробная активность, чтобы облегчить более точное прогнозирование биоактивной эффективности в различных реальных условиях.
д. Поэтому существует необходимость в экспериментальные исследования, чтобы преодолеть разрыв между строго контролируемыми лабораторными экспериментами и реалистичными полевыми условиями.Такие эксперименты, т.е. Эксперименты с мезокосмом растений и почвы должны быть направлены на выяснение судьбы и активности ключевых метаболитов в ризосфере в зависимости, например, от текстура почвы, структура, pH, температура и микробная активность, чтобы облегчить более точное прогнозирование биоактивной эффективности в различных реальных условиях.
В течение последних пяти лет были опубликованы первые исследования, направленные на установление того, как химические вещества корня регулируют экспрессию генов у нематод, паразитирующих на растениях. Мы предвидим, что дальнейшее раскрытие молекулярных реакций нематод на определенные корневые метаболиты и, следовательно, глубокое понимание способов их действия поможет нам предсказать, какие соединения обладают наибольшим потенциалом для эффективного контроля или управления нематодами, паразитирующими на растениях.
В целом, мы предлагаем сосредоточить дальнейшие разработки на нематоцидных видах растений и соединениях с биоцидной активностью против широкого спектра паразитических нематод, а также других патогенных организмов и организмов-вредителей, чтобы облегчить комплексную борьбу с различными вредителями растений. Следовательно, селекция и дальнейшая селекция сортов, продуцирующих высокие уровни нематоцидных или репеллентных метаболитов, может привести к получению более устойчивых к нематодам сортов. В высокоценных садовых культурах, т.е. прививка культур томата на подвои с высокой продукцией репеллентных или нематоцидных метаболитов может стать быстрой альтернативой длительному процессу селекции.
Поскольку нетравоядные почвенные нематоды способствуют процессам разложения, доступности неорганических питательных веществ и даже борьбе с личинками растительноядных насекомых, важно учитывать, оказывают ли метаболиты, токсичные для нематод, паразитирующих на растениях, отрицательное воздействие на эти родственные нецелевые организмы. Лишь в ограниченном числе исследований оценивалось, как растительные метаболиты, подавляющие нематоды, паразитирующие на растениях, влияют на нематод, не являющихся мишенями, и с разными результатами. Поэтому мы не можем сделать каких-либо общих выводов о чувствительности микробоядных и энтомопатогенных видов или сообществ нематод к метаболитам корней.
Лишь в ограниченном числе исследований оценивалось, как растительные метаболиты, подавляющие нематоды, паразитирующие на растениях, влияют на нематод, не являющихся мишенями, и с разными результатами. Поэтому мы не можем сделать каких-либо общих выводов о чувствительности микробоядных и энтомопатогенных видов или сообществ нематод к метаболитам корней.
Вклад авторов
MS и MV в равной степени внесли свой вклад в разработку концепции и подготовку рукописи.
Финансирование
MS финансировалась за счет гранта Орхусского университета, а MV поддерживалась стартовым грантом Исследовательского фонда Орхусского университета.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы благодарим Орхусский университет и Исследовательский фонд Орхусского университета за финансирование этого исследования.
Ссылки
Чепулите, Р., Данква, В. Б., Брюнинг, Г., Уильямсон, В. М. (2018). Мощный аттрактант для галловых нематод в выделениях из кончиков корней проростков двух видов-хозяев. наук. Rep. 8 (1), 10847. doi: 10.1038/s41598-018-29165-4
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Айрес, А., Карвальо, Р., да Барбоза, М.С., Роза, Э. (2009). Подавление картофельной нематоды Globodera rostochiensis с экстрактами растений Brassicacea. утра. Дж. Картофель Рез. 86 (4), 327–333. doi: 10.1007/s12230-009-9086-y
CrossRef Full Text | Google Scholar
Айссани Н., Ургеге П. П., Оплос К., Саба М., Токко Г., Петретто Г. Л. и др. (2015). Нематоцидная активность летучей мыши Eruca sativa в отношении Meloidogyne incognita. Дж. Агрик. Пищевая хим. 63 (27), 6120–6125.doi: 10.1021/acs.jafc.5b02425
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Андраде, Л.Б.Д.С., Оливейра, А. С., Рибейро, Дж.К.С., Киёта, С., Васконселос, И.М., Де Оливейра, Дж.Т.А., и др. (2010). Эффекты нового белка класса 10 (PR-10), связанного с патогенезом, из корней Crotalaria pallida с ингибирующей активностью папаина против галловой нематоды Meloidogyne incognita. Дж. Агрик. Пищевая хим. 58, 4145–4152. doi: 10.1021/jf
С., Рибейро, Дж.К.С., Киёта, С., Васконселос, И.М., Де Оливейра, Дж.Т.А., и др. (2010). Эффекты нового белка класса 10 (PR-10), связанного с патогенезом, из корней Crotalaria pallida с ингибирующей активностью папаина против галловой нематоды Meloidogyne incognita. Дж. Агрик. Пищевая хим. 58, 4145–4152. doi: 10.1021/jf
56
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Асрес, К., Спорер, Ф., Винк, М. (2004). Структура пирролизидиновых алкалоидов у 12 эфиопских видов Crotalaria. Биохим. Сист. Экол. 32 (10), 915–930. doi: 10.1016/j.bse.2004.03.004
Полный текст CrossRef | Google Scholar
Авато П., Д’Аддаббо Т., Леонетти П., Арджентьери М. П. (2013). Нематоцидный потенциал Brassicaceae Phytochem. Ред. 12, 791–802. doi: 10.1007/s11101-013-9303-7
Полный текст CrossRef | Google Scholar
Басетти, А.A., Snook, M.E., Glenn, A.E., Noe, J.P., Hill, N., Culbreath, A., et al. (2009). Токсичность инфицированных эндофитами алкалоидов овсяницы тростниковой и метаболитов злаков на Pratylenchus scribneri. Фитопатология 99 (12), 1336–1345. doi: 10.1094/PHYTO-99-12-1336
Фитопатология 99 (12), 1336–1345. doi: 10.1094/PHYTO-99-12-1336
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Белл, К.А., Лилли, К.Дж., Маккарти, Дж., Аткинсон, Х.Дж., Урвин, П.Е. (2019). Нематоды, паразитирующие на растениях, реагируют на сигналы корневого экссудата специфичными для хозяина паттернами экспрессии генов. Плос Патог. 15 (2), е1007503. doi: 10.1371/journal.ppat.1007503
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Бхаттараи К.К., Се К.-Г., Мантелин С., Бишной У., Гирке Т., Наварра Д.А. и др. (2008). Восприимчивость томатов к галловым нематодам требует интактного сигнального пути жасмоновой кислоты. Мол. Растение-микроб В. 21 (9), 1205–1214. doi: 10.1094/MPMI-21-9-1205
Полный текст CrossRef | Google Scholar
Бьёрнлунд, Л., Лю, М. К., Ронн, Р., Кристенсен, С., Экелунд, Ф. (2012). Нематоды и простейшие по-разному воздействуют на растения в зависимости от питательного статуса почвы. евро. J. Почвенная биология. 50, 28–31. doi: 10.1016/j.ejsobi.2011.11.012
евро. J. Почвенная биология. 50, 28–31. doi: 10.1016/j.ejsobi.2011.11.012
CrossRef Полный текст | Google Scholar
Бринкман, Э. П., ван Вин, Дж. А., ван дер Путтен, У. Х. (2004). Эндопаразитические нематоды уменьшают размножение эктопаразитических нематод, но не предотвращают снижение роста Ammophila arenararia (L.) Link (трава маррам). Заяв. Экологичность почвы. 27 (1), 65–75. doi: 10.1016/j.apsoil.2004.02.004
Полный текст CrossRef | Google Scholar
Бролсма, К.М., ван дер Салм, Р.Дж., Хоффланд, Э., де Гёде, Р.Г.М. (2014). Вылупление Globodera pallida ингибируется 2-пропенилизотиоцианатом in vitro , но не включением ткани Brassica juncea в почву. Заяв. Экологичность почвы. 84, 6–11. doi: 10.1016/j.apsoil.2014.05.011
CrossRef Полный текст | Google Scholar
Бунчу И., Raps, D.A., Joseph, I., Reid, C., Chait, A., Totanes, R., et al. (2018). Нейропептиды FLP-1 модулируют сенсорные и моторные цепи у нематоды Caenorhabditis elegans. PLoS One 13 (1), e0189320. doi: 10.1371/journal.pone.0189320
PLoS One 13 (1), e0189320. doi: 10.1371/journal.pone.0189320
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Бусков С., Серра Б., Роза Э., Соренсен Х., Соренсен Дж. К. (2002). Влияние интактных глюкозинолатов и продуктов, полученных из глюкозинолатов в результате гидролиза, катализируемого мирозиназой, на картофельную цистообразующую нематоды ( G lobodera rostochiensis cv.Уолл). Дж. Агрик. Пищевая хим. 50 (4), 690–695. doi: 10.1021/jf010470s
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Бирн, Дж. Т., Махер, Нью-Джерси, Джонс, П. В. (2001). Сравнительная реакция Globodera rostochiensis и G. pallida на инкубационные химикаты. J. Нематол. 33 (4), 195–202.
Реферат PubMed | Google Scholar
Чапарро Дж. М., Бадри Д. В., Баккер М. Г., Сугияма А., Мантер Д. К., Виванко Дж. М. (2013). Корневая экссудация фитохимических веществ у арабидопсиса следует определенным закономерностям, которые запрограммированы в процессе развития и коррелируют с микробными функциями почвы. PLoS ONE 8 (2), e55731. doi: 10.1371/journal.pone.0055731
PLoS ONE 8 (2), e55731. doi: 10.1371/journal.pone.0055731
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Чен Дж., Феррис Х. (1999). Влияние выедания нематод на минерализацию азота при грибковом разложении органического вещества. Почвенный биол. Биохим. 31 (9), 1265–1279. doi: 10.1016/S0038-0717(99)00042-5
Полный текст CrossRef | Google Scholar
Кларк, А. Дж., Шеперд, А. М. (1966). Пикролоновая кислота как агент вылупления картофельной нематоды Heterodera rostochiensis Woll. Nature 211 (5048), 546. doi: 10.1038/211546a0
CrossRef Полный текст | Google Scholar
Кусманс, Дж. (2005). Диметилдисульфид (DMDS): потенциальный новый нематоцид и дезинфицирующее средство для почвы. Акта Хортик. 698, 57–64. doi: 10.17660/ActaHortic.2005.698.6
Полный текст CrossRef | Google Scholar
Curtis, RHC, Robinson, AF, Perry, RN (2009). «Расположение люка и хозяина», в ГАЛЛИКОВЫЕ НЕМАТОДЫ . ред. Перри, Р. Н., Моэнс, М., Старр, Дж. Л. (Уоллингфорд, Великобритания: CABI), 139–162. doi: 10.1079/9781845934927.0139
ред. Перри, Р. Н., Моэнс, М., Старр, Дж. Л. (Уоллингфорд, Великобритания: CABI), 139–162. doi: 10.1079/9781845934927.0139
Полный текст CrossRef | Google Scholar
Курто Г., Донгиованни К., Сасанелли Н., Сантори А., Мирта А. (2014). Эффективность диметилдисульфида (DMDS) в борьбе с галловой нематодой Meloidogyne incognita и цистообразующей нематодой Heterodera carotae на моркови в полевых условиях в Италии. Акта Хортик. 1044, 405–410. doi: 10.17660/ActaHortic.2014.1044.55
CrossRef Полный текст | Google Scholar
Д’Аддаббо, Т., Карбонара Т., Леонетти П., Радиччи В., Тава А., Авато П. (2011). Борьба с нематодами, паразитирующими на растениях, с помощью активных сапонинов и биомассы Medicago sativa. Фитохим. Ред. 10 (4), 503–519. doi: 10.1007/s11101-010-9180-2
Полный текст CrossRef | Google Scholar
da Silva, JCP, Campos, VP, Barros, A.F., Pedroso, L.A., Silva, M.d.F., de Souza, JT, et al. (2019). Действие летучих веществ, выделяемых различными видами растений, на молодь и яйца Meloidogyne incognita. Защита урожая. 116, 196–203. doi: 10.1016/j.cropro.2018.11.006
Защита урожая. 116, 196–203. doi: 10.1016/j.cropro.2018.11.006
CrossRef Полный текст | Google Scholar
Дандуранд, Л. М., Кнудсен, Г. Р. (2016). Влияние ловушки Solanum sisymbriifolium и двух биоконтролирующих грибов на размножение картофельной цистообразующей нематоды Globodera pallida. Энн. заявл. биол. 169, 180–189. doi: 10.1111/aab.12295
Полный текст CrossRef | Google Scholar
Дэвис Э. Л., Мейерс Д. М., Дуллум С. Дж., Фейтельсон Дж.С. (1997). Нематоцидная активность эфиров жирных кислот в отношении цист сои и галловых нематод. J. Нематол. 29 (4С), 677–684.
Реферат PubMed | Google Scholar
Девайн, К. Дж., Джонс, П. В. (2003). Исследование хемоаттракции цистообразующих нематод картофеля Globodera rostochiensis и G. pallida к фракционированному фильтрату корней картофеля. Нематология 5 (5), 65–75. doi: 10.1163/156854102765216704
CrossRef Полный текст | Google Scholar
Диас, М.C., Conceição, IL, Abrantes, I. , Cunha, MJ (2012). Solanum sisymbriifolium — новый подход к борьбе с нематодами, паразитирующими на растениях. евро. Дж. Плант Патол. 133 (1), 171–179. doi: 10.1007/s10658-012-9945-0
, Cunha, MJ (2012). Solanum sisymbriifolium — новый подход к борьбе с нематодами, паразитирующими на растениях. евро. Дж. Плант Патол. 133 (1), 171–179. doi: 10.1007/s10658-012-9945-0
CrossRef Полный текст | Google Scholar
Диас, М. К., Перпетуо, Л. С., Кабрал, А. Т., Гильерме, Р., да Кунья, М. Дж. М., Мело, Ф., и др. (2017). Воздействие Solanum sisymbriifolium на популяции картофельной цистообразующей нематоды в Португалии. Растительная почва 421 (1-2), 439–452.doi: 10.1007/s11104-017-3475-7
CrossRef Полный текст | Google Scholar
Л. Донг, X. Ли, Л. Хуанг, Ю. Гао, Л. Чжун, Ю. Чжэн и др. (2014). Лауриновая кислота в корневом экссудате ромашки мощно регулирует хемотаксис галловых нематод и нарушает экспрессию Mi-flp-18, чтобы блокировать инфекцию. Дж. Экспл. Бот. 65 (1), 131–141. doi: 10.1093/jxb/ert356
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Донг Л., Ли Х., Хуанг К., Лу К., Ли Б., Yao, Y. , et al. (2018). Уменьшение заражения томата Meloidogyne incognita в присутствии клещевины и при участии жирных кислот. наук. Хортик. 237, 169–175. doi: 10.1016/j.scienta.2018.03.066
, et al. (2018). Уменьшение заражения томата Meloidogyne incognita в присутствии клещевины и при участии жирных кислот. наук. Хортик. 237, 169–175. doi: 10.1016/j.scienta.2018.03.066
Полный текст CrossRef | Google Scholar
Дуарте, А., Малейта, К., Абрантес, И., Кертис, Р. (2015). Экссудаты корней томатов индуцируют транскрипционные изменения генов Meloidogyne hispanica. Фитопат. Медитерр. 54 (1), 104–108. doi: 10.14601/Phytopathol_Mediterr-14595
CrossRef Полный текст | Google Scholar
Дюсеппе, М.О., Лафонд-Лапальм Дж., Паломарес-Риус Дж. Э., Сабе М., Блок В., Моффет П. и соавт. (2017). Анализ транскриптомов выживания и вылупления картофельных цистообразующих нематод, Globodera rostochiensis и G. pallida. наук. Rep. 7 (1), 3882. doi: 10.1038/s41598-017-03871-x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Датта Т.К., Пауэрс С.Дж., Гаур Х.С., Биркетт М., Кертис Р.Х.К. (2012). Влияние малых липофильных молекул в экссудатах корней томата и риса на поведение Meloidogyne incognita и M. граминикола. Нематология 14 (3), 309–320. doi: 10.1163/156854111X612306
граминикола. Нематология 14 (3), 309–320. doi: 10.1163/156854111X612306
Полный текст CrossRef | Google Scholar
Датта, Т.К., Хан, М.Р., Фани, В. (2019). Борьба с нематодами, паразитирующими на растениях, посредством биофумигации с использованием растений семейства крестоцветных и других растений: текущее состояние и перспективы на будущее. Курс. биол. растений 17, 17–32. doi: 10.1016/j.cpb.2019.02.001
Полный текст CrossRef | Google Scholar
Эльхади А., Адсс С., Холлманн Дж., Хойер, Х. (2018). Микробиомы ризосферы, модулированные предварительными посевами, помогали растениям защищаться от нематод, паразитирующих на растениях. Фронт. микробиол. 9, 1133. doi: 10.3389/fmicb.2018.01133
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Эскудеро Мартинес, К. М., Гварнери, Н., Овермарс, Х., ван Шайк, К., Боумистер, Х., Рюйтер-Спира, К., и др. (2019). Различная роль стриголактонов в паразитизме цистообразующих нематод корней арабидопсиса. евро. Дж. Плант Патол. 154 (1), 129–140. doi: 10.1007/s10658-019-01691-5
евро. Дж. Плант Патол. 154 (1), 129–140. doi: 10.1007/s10658-019-01691-5
CrossRef Full Text | Google Scholar
Эвенхейс, А., Корталс, Г.В., Молендейк, Л.П.Г. (2004). Tagetes patula как эффективная промежуточная культура для долгосрочной борьбы с Pratylenchus penetrans. Нематология 6 (6), 877–881. doi: 10.1163/1568541044038632
Полный текст CrossRef | Google Scholar
Fahey, JW, Zalcmann, AT, Talalay, P. (2001). Химическое разнообразие и распределение глюкозинолатов и изотиоцианатов среди растений. Фитохимия 56, 5–51. doi: 10.1016/S0031-9422(00)00316-2
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Файзи С., Файяз С., Бано С., Явар Икбал Э., Лубна Л., Сиддики Х. и др. (2011). Выделение нематоцидных соединений из желтых цветков Tagetes patula L.: исследования взаимосвязи структура-активность в отношении личинок инфекционной стадии цистовой нематоды Heterodera zeae. Дж. Агрик. Пищевая хим. 59 (17), 9080–9093. doi: 10.1021/jf201611b
doi: 10.1021/jf201611b
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Фарнье, К., Бенгтссон, М., Бехер, П.Г., Витцель, Дж., Витцгалл, П., Мандурик, С. (2012). Новый биоанализ демонстрирует привлечение нематоды белой картофельной цисты Globodera pallida (Stone) к нелетучим и летучим сигналам растения-хозяина. J. Chem. Экол. 38, 795–801. doi: 10.1007/s10886-012-0105-y
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Флеминг Т. Р., Моле А. Г., Флеминг К. С. (2017). Хемосенсорные реакции нематод, паразитирующих на растениях, на отдельные фитохимические вещества выявляют черты долговременного привыкания. J. Нематол. 49 (4), 462–471.
Реферат PubMed | Google Scholar
Флорес, А.С., Тоцци, A.M.G.d.A., Триго, Дж. Р. (2009). Профили пирролизидиновых алкалоидов у видов Crotalaria из Бразилии: хемотаксономическое значение. Биохим. Сист. Экол. 37 (4), 459–469. doi: 10.1016/j.bse.2009. 06.001
06.001
Полный текст CrossRef | Google Scholar
Фомсгаард И.С., Мортенсен А.Г., Карлсен С.К.К. (2004). Продукты микробной трансформации бензоксазолинона и аллелохимические препараты бензоксазинона — обзор. Хемосфера 54 (8), 1025–1038. doi: 10.1016/j.chemosphere.2003.09.004
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Фури Х., Ахуджа П., Ламмерс Дж., Дэниел М. (2016). Стратегии управления на основе Brassicacea как альтернатива борьбе с нематодами-вредителями: краткий обзор. Защита урожая. 80, 21–41. doi: 10.1016/j.cropro.2015.10.026
CrossRef Полный текст | Google Scholar
Фрю А., Пауэлл Дж. Р., Глаузер Г., Беннетт А. Э., Джонсон, С. Н. (2018). Микоризные грибы усиливают поглощение питательных веществ, но разрушают защитные силы корней растений, способствуя развитию популяций нематод, паразитирующих на растениях. Почвенный биол. Биохим. 126, 123–132. doi: 10.1016/j.soilbio.2018.08.019
Полный текст CrossRef | Google Scholar
Fudali, S. L., Wang, C., Williamson, VM (2012). Этиленовый сигнальный путь модулирует привлекательность корней хозяина для галловой нематоды Meloidogyne hapla. Мол. Растение-микроб В. 26 (1), 75–86.doi: 10.1094/MPMI-05-12-0107-R
L., Wang, C., Williamson, VM (2012). Этиленовый сигнальный путь модулирует привлекательность корней хозяина для галловой нематоды Meloidogyne hapla. Мол. Растение-микроб В. 26 (1), 75–86.doi: 10.1094/MPMI-05-12-0107-R
Полный текст CrossRef | Google Scholar
Фудзимото Т., Томитака Ю., Абэ Х., Цуда С., Футай К., Мизукубо Т. (2011). Профиль экспрессии генов, индуцированных жасмоновой кислотой, и индуцированная устойчивость к галловой нематоде (Meloidogyne incognita) в растениях томата (Solanum lycopersicum) после некорневой обработки метилжасмонатом. J. Физиол растений. 168 (10), 1084–1097. doi: 10.1016/j.jplph.2010.12.002
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Фукудзава А., Фурусаки А., Икура М., Масамунэ Т. (1985). Глициноклепин А, естественный стимул вылупления цистообразующих нематод сои. J. Chem. соц. хим. коммун. , 222–224. doi: 10.1039/c39850000222
Полный текст CrossRef | Google Scholar
Галатти Ф. С., Франко А.Дж., Ито Л.А., Чарло Х.К.О., Гайон Л.А., Л.Т., Б. (2013). Подвои, устойчивые к Meloidogyne incognita, и совместимость прививки в сеточную дыню. Revista Ceres 60 (3), 432–436. дои: 10.1590/S0034-737X2013000300018
С., Франко А.Дж., Ито Л.А., Чарло Х.К.О., Гайон Л.А., Л.Т., Б. (2013). Подвои, устойчивые к Meloidogyne incognita, и совместимость прививки в сеточную дыню. Revista Ceres 60 (3), 432–436. дои: 10.1590/S0034-737X2013000300018
CrossRef Полный текст | Google Scholar
Глисон К., Лиларасами Н., Мелдау Д., Фойсснер И. (2016). OPDA играет ключевую роль в регулировании восприимчивости растений к галловой нематоде Meloidogyne hapla у арабидопсиса. Фронт. Растениевод. 8, 1565 doi: 10.3389/fpls.2016.01565
CrossRef Full Text | Google Scholar
Гоммерс, Ф. Дж., Баккер, Дж. (1988). «Физиологические заболевания, вызванные реакцией растений или продуктами», в Болезни нематод .ред. Пойнар, Г. О., Янссон, Х. Б. (Бока-Ратон, Флорида: CRC Press, Inc.), 3–22.
Google Scholar
Гувейя М., Кордейро Н., Тейшейра Л., Абрантес И. Д. О., Пестана М., Родригес М. (2014). In vitro оценка нематоцидных свойств экстрактов Solanum sisymbriifolium и S. nigrum на Pratylenchus goodeyi. Нематология 16 (1), 41–51. doi: 10.1163/15685411-00002743
CrossRef Полный текст | Google Scholar
Hütsch, B.W., Augustin, J., Мербах, В. (2002). Ризоотложение растений — важный источник круговорота углерода в почве. J. Питательные вещества для растений. Почвовед. 165, 397–407. doi: 10.1002/1522-2624(200208)165:4<397::AID-JPLN397>3.0.CO;2-C
CrossRef Полный текст | Google Scholar
Хамагути Т., Сато К., Висенте К. С. Л., Хасегава К. (2019). Нематоцидное действие экссудата календулы альфа-тертиенил: вызывающее окислительный стресс соединение проникает в гиподерму нематод. Биол. Открыть 8 (4), био038646.doi: 10.1242/bio.038646
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Хаммербахер А., Коутиньо Т. А., Гершензон Дж. (2019). Роль летучих веществ растений в защите от микробных патогенов и микробной эксплуатации летучих веществ. Окружающая среда клеток растений. 42 (10), 2827–2843. doi: 10.1111/pce.13602
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Арутюнян Г. (2015). Использование биофумигационных культур в качестве альтернативы бромистому метилу для борьбы с галловой нематодой при выращивании огурцов в теплицах (Франция: доктор философии, Парижский технологический институт).
Google Scholar
Хендерсон Д. Р., Рига Э., Рамирес Р. А., Уилсон Дж., Снайдер В. Э. (2009). Биофумигация ипритом нарушает биологический контроль Steinernema spp. нематод в почве. Биол. Контроль 48 (3), 316–322. doi: 10.1016/j.biocontrol.2008.12.004
CrossRef Полный текст | Google Scholar
Хенми, В., Марахатта, С. (2018). Воздействие листвы конопли Sunn и шелухи ореха макадамия на паразитических и полезных нематод растений. Nematropica 48 (1), 34–37.
Google Scholar
Hiltpold, I., Turlings, T.C.J. (2008). Подземная химическая сигнализация кукурузы: когда простота рифмуется с эффективностью. J. Chem. Экол. 34 (5), 628–635. doi: 10.1007/s10886-008-9467-6
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Hiltpold, I., Jaffuel, G., Turlings, T.C.J. (2015). Двойное воздействие экссудата корневого чехлика на нематод: от покоя у нематод, паразитирующих на растениях, до безумия у энтомопатогенных нематод. Дж. Экспл. Бот. 66 (2), 603–611. doi: 10.1093/jxb/eru345
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Hol, WHG (2011). Влияние питательных веществ на пирролизидиновые алкалоиды в растениях Senecio и их взаимодействие с травоядными и патогенами. Фитохим. Ред. 10 (1), 119–126. doi: 10.1007/s11101-010-9188-7
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Хукс С. Р. Р., Ван К. Х., Плоэг А., МакСорли Р.(2010). Использование бархатцев (Tagetes spp.) в качестве покровной культуры для защиты сельскохозяйственных культур от нематод, паразитирующих на растениях. Заяв. Экологичность почвы. 46 (3), 307–320. doi: 10.1016/j.apsoil.2010.09.005
CrossRef Полный текст | Google Scholar
Хойстед, Г. А., Белл, К. А., Лилли, К. Дж., Урвин, П. Е. (2018). Колонизация тлей влияет на состав корневого экссудата картофеля и вылупление почвенного патогена. Фронт. Растениевод. 9, 1278. doi: 10.3389/fpls.2018.01278
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Ху, Ю., You, J., Li, C., Williamson, VM, Wang, C. (2017). Путь ответа на этилен модулирует привлекательность корней растений для цистообразующих нематод сои Heterodera glycines. наук. Rep. 7, 41282. doi: 10.1038/srep41282
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Ингам, Р. Э., Трофимов, Дж. А., Ингам, Э. Р., Коулман, округ Колумбия (1985). Взаимодействие бактерий, грибов и питающихся ими нематод — влияние на круговорот питательных веществ и рост растений. Экол. моногр. 55 (1), 119–140. doi: 10.2307/1942528
Полный текст CrossRef | Google Scholar
Джонс Дж. Т., Хегеман А., Данчин Э. Г. Дж., Гаур Х. С., Хелдер Дж., Джонс М. Г. К. и др. (2013). Топ-10 фитопаразитических нематод в молекулярной патологии растений. Мол. Завод Патол. 14 (9), 946–961. doi: 10.1111/mpp.12057
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Каммерхофер Н., Радакович З., Регис Дж. М. А., Добрев П., Ванкова Р., Grundler, F.M.W., et al. (2015). Роль гормонов, связанных со стрессом, в защите растений при раннем заражении цистообразующей нематодой Heterodera schachtii у арабидопсиса. Новый Фитол. 207 (3), 778–789. doi: 10.1111/nph.13395
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Карими М., Монтегю М., Гейзен Г. (1995). Экзогенное применение абсцизовой кислоты к растениям картофеля подавляет репродукцию Meloidogyne incognita. Mededelingen Faculteit Landbouwkundige En Toegepaste Biologische Wetenschappen Universiteit Gent 60, 1033–1035.
Google Scholar
Кавайде, Т. (1985). Использование подвоев в производстве бахчевых культур в Японии. Jarq-Japan Agric. Рез. Q. 18 (4), 284–289.
Google Scholar
Кая, Х.К., Канаги, Дж.М.Н. (2010). Возможная роль корней ноготков и α-тертиенила в поиске хозяина нематодами Steinernematid. Nematologica 42 (2), 220–231. doi: 10.1163/004325996X00066
Полный текст CrossRef | Google Scholar
Кемпстер, В.Н., Дэвис, К.А., Скотт, Э.С. (2001). Химическая и биологическая индукция устойчивости к клеверной нематоде (Heterodera trifolii) у белого клевера (Trifolium repens). Нематология . 3 (1), 35–43 doi: 10.1163/156854101300106874
CrossRef Full Text | Google Scholar
Кихика Р., Мурунги Л. К., Койн Д., Нганга М., Хассанали А., Тил П. Е. А. и др. (2017). Взаимодействия паразитической нематоды Meloidogyne incognita с различными сортами Capsicum annum выявляют химические компоненты, модулирующие травоядность корней. наук. Rep. 7 (1), 2903. doi: 10.1038/s41598-017-02379-8
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Кимбер, М. Дж., МакКинни, С., Макмастер, С., Дэй, Т. А., Флеминг, К. С., Моле, А. Г. (2007). Нарушение гена flp у паразитической нематоды выявляет моторную дисфункцию и необычную чувствительность нейронов к интерференции РНК. FASEB J. 21 (4), 1233–1243. doi: 10.1096/fj.06-7343com
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Кирва, Х.К., Мурунги, Л.К., Бек, Дж.Дж., Торто, Б. (2018). Выявление дифференциальных ответов галловой нематоды Meloidogyne incognita на цитокинин, флавоноиды и алкалоиды корневого экссудата томата. Дж. Агрик. Пищевая хим. 66 (43), 11291–11300. doi: 10.1021/acs.jafc.8b05101
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Корталс, Г. В., Тоден, Т. К., ван ден Берг, В., Виссер, Дж. Х. М. (2014). Долгосрочные эффекты восьми обработок почвы для борьбы с нематодами, паразитирующими на растениях, и Verticillium dahliae в агроэкосистемах. Заяв. Экологичность почвы. 76, 112–123. doi: 10.1016/j.apsoil.2013.12.016
CrossRef Полный текст | Google Scholar
Куджорджи Э. Н., Сапкота Р., Штеффенсен С. К., Фомсгаард И. С., Николайсен М. (2019). Бензоксазиноиды, синтезированные кукурузой, влияют на микробиом, связанный с хозяином. Микробиом 7, 59. doi: 10.1186/s40168-019-0677-7
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Куй В., Чао Л., Хао Л., Цзяньмэй X., Вейбо С., Лиган З.(2015). Нематоцидная активность алкалоидов Macleaya cordata в отношении некоторых нематод. фр. Дж. Агрик. Рез. 7 (44), 5925–5929. doi: 10.5897/AJAR11.1940
Полный текст CrossRef | Google Scholar
Кусида А., Сува Н., Уэда Ю., Момота Ю. (2003). Влияние Crotalaria juncea и C. spectabilis на вылупление и плотность популяции соевой нематоды Heterodera glycines (Tylenchida: Heteroderidae). Заяв. Энтомол. Зоол. 38 (3), 393–399.doi: 10.1303/aez.2003.393
Полный текст CrossRef | Google Scholar
Киндт Т., Нахар К., Хек А., Вербек Р., Деместер К., Гейзен Г. (2017). Взаимодействие между каротиноидами, абсцизовой кислотой и жасмонатом определяет совместимое взаимодействие риса и мелоидогина граминикола. Фронт. Растениевод. 8, 951. doi: 10.3389/fpls.2017.00951
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Кё М., Мияучи Ю., Фудзимото Т., Маяма С. (1990). Продукция нематоцидных соединений культурами волосатых корней Tagetes patula L. Представитель клеток растений 9, 393–397. doi: 10.1007/BF00232407
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Лопес-Аранда, Дж. М., Миранда, Л., Сориа, К., Перес-Хименес, Р. М., Зеа, Т., Талавера, М., и др. (2009). Химические альтернативы бромистому метилу для клубники в районе Уэльвы (Испания): результаты 2002–2007 годов. Акта Хортик. (Вагенинген) 2, 957–960. doi: 10.17660/ActaHortic.2009.842.212
Полный текст CrossRef | Google Scholar
Лэмбрикс, В., Reichelt, M., Mitchell-Olds, T., Kliebenstein, D.J., Gershenzon, J. (2007). Белок эпитиоспецификатора арабидопсиса способствует гидролизу глюкозинолатов до нитрилов и влияет на травоядных Trichoplusia ni. Растительная клетка 13 (12), 2793–2807. doi: 10.2307/3871535
Полный текст CrossRef | Google Scholar
LaMondia, JA (1995). Вылупление и размножение Globodera tabacum tabacum в ответ на табак, томат или черный паслен. J. Нематол. 27 (3), 382–386.
Реферат PubMed | Google Scholar
Lazzeri, L., Tacconi, R., Palmieri, S. (1993). Активность in vitro некоторых глюкозинолатов и продуктов их реакции в отношении популяции нематод Heterodera schachtii. Дж. Агрик. Пищевая хим. 41 (5), 825–829. doi: 10.1021/jf00029a028
CrossRef Полный текст | Google Scholar
Лаццери Л., Курто Г., Леони О., Даллавалле Э. (2004). Влияние глюкозинолатов и продуктов их ферментативного гидролиза через мирозиназу на галловую нематоды Meloidogyne incognita (Kofoid et White) Chitw. Дж. Агрик. Пищевая хим. 52 (22), 6703–6707. doi: 10.1021/jf030776u
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Леоката С., Пирруччо Г., Мирта А., Медико Э., Греко Н. (2014). Диметилдисульфид (DMDS): новый почвенный фумигант для борьбы с галловыми нематодами, Meloidogyne spp., на защищенных культурах на Сицилии, Италия. Акта Хортик. 1044, 415–420. doi: 10.17660/ActaHortic.2014.1044.57
CrossRef Полный текст | Google Scholar
Ли Т., Ван Х., Ся С., Цао С., Яо Дж., Чжан Л. (2018). Ингибирующее действие компонентов корневого экссудата лука обыкновенного на галловые нематоды. PloS One 13 (7), e0201471. doi: 10.1371/journal.pone.0201471
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Лопес-Перес, Дж. А., Рубцова, Т., Плоэг, А. (2005). Влияние трех растительных остатков и куриного помета, используемых в качестве биофумигантов при трех температурах, на заражение томата Meloidogyne incognita в экспериментах в теплице. J. Нематол. 37 (4), 489–494.
Реферат PubMed | Google Scholar
Marles, R.J., Hudson, J.B., Graham, E.A., Soucy-Breau, C., Morand, P., Compadre, R.L., et al. (1992). Структурно-активные исследования фотоактивированных противовирусных и цитотоксических трициклических тиофенов. Фотохим. Фотобиол. 56, 479–487. doi: 10.1111/j.1751-1097.1992.tb02191.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Маршнер, П. (2012). Минеральное питание высших растений (Амстердам: Elsevier Ltd.).
Google Scholar
Марури-Лопес И., Авилес-Бальтазар Н.Ю., Бучала А., Серрано М. (2019). Внутри- и внеклеточное путешествие фитогормона салициловой кислоты. Фронт. Растениевод. 10, 423. doi: 10.3389/fpls.2019.00423
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Масамунэ Т., Анетай М., Фукудзава А., Такасуги М., Мацуэ Х., Кобаяши К. и др. (1987). Глициноклепины, естественные стимулы вылупления соевой нематоды, глицины Heterodera.II Структурное разъяснение. Бык. хим. соц. Япония. 60 (3), 981–999. doi: 10.1246/bcsj.60.981
CrossRef Полный текст | Google Scholar
МакСорли Р., Сил Д. Р., Классен В., Ван К.-Х., Хукс С. Р. Р. (2009). Нецелевое воздействие покровных культур конопли и бархатцев на почвенное сообщество беспозвоночных. Нематропика 39, 235–245.
Google Scholar
Мейер С.Л.Ф., Райс С.П., Засада И.А. (2009). DIBOA: судьба в почве и влияние на количество яиц галловых нематод. Почвенный биол. Биохим. 41 (7), 1555–1560. doi: 10.1016/j.soilbio.2009.04.016
CrossRef Полный текст | Google Scholar
Мейер С. Л. Ф., Ничепир А. П., Рупрехт С. М., Митчелл А. Д., Мартин П. А. В., Браш С. В. и др. (2013). Овсяница тростниковая ‘Jesup (max-Q)’: развитие meloidogyne incognita в корнях и нематотоксичность. Агрон. J. 105 (3), 755–763. doi: 10.2134/agronj2012.0374
Полный текст CrossRef | Google Scholar
Молинари, С.(2016). Активация системной приобретенной устойчивости у пасленовых культур как стратегия борьбы с галловыми нематодами. Борьба с вредителями науч. 72 (5), 888–896. doi: 10.1002/ps.4063
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Мусави, М. Р. (2017). Влияние гиббереллина и абсцизовой кислоты на защитные реакции растений и на тяжесть заболевания, вызванного Meloidogyne javanica на растениях томатов. J. Общий завод Патол. 83 (3), 173–184. дои: 10.1007/s10327-017-0708-9
Полнотекстовая перекрестная ссылка | Google Scholar
Моралло-Рейесус, Б., Десена, А. (1982). Активность, выделение, очистка и идентификация инсектицидных принципов бархатцев. Филипп. J. Crop Sci. 7, 31–36.
Google Scholar
Мослеми Ф., Фатеми С., Бернард Ф. (2016). Ингибирующее действие салициловой кислоты на репродукцию Meloidogyne javanica у растений томата. Диапазон. Дж. Агрик. Рез. 14 (1), 1–7. дои: 10.5424/sjar/2016141-8706
Полный текст CrossRef | Google Scholar
Мурунги Л.К., Кирва Х., Койн Д., Тил П.Е.А., Бек Дж.Дж., Торто Б. (2018). Идентификация ключевых летучих веществ корня, сигнализирующих о предпочтении помидоров шпинату корневой нематодой Meloidogyne incognita. Дж. Агрик. Пищевая хим. 66 (28), 7328–7336. doi: 10.1021/acs.jafc.8b03257
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Мирта А., Сантори А., Занон М. Дж., Цимбукис, Н., де Врис, Р., де Томмазо, Н. (2018). Эффективность диметилдисульфида (DMDS) для борьбы с галловой нематодой в защищенных помидорах в южной Европе. Акта Хортик. 1207, 123–128. doi: 10.17660/ActaHortic.2018.1207.16
CrossRef Полный текст | Google Scholar
Нахар К., Киндт Т., Де Влесшаувер Д., Хёфте М., Гейзен Г. (2011). Жасмонатный путь является ключевым игроком в системно индуцированной защите риса от галловых нематод. Завод физиол. 157 (1), 305–316. doi: 10.1104/pp.111.177576
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Nasiou, E., Giannakou, IO (2018). Действие гераниола, спиртового монотерпенового масла на растительной основе, на Meloidogyne javanica. евро. Дж. Плант Патол. 152 (3), 701–710. doi: 10.1007/s10658-018-1512-x
CrossRef Полный текст | Google Scholar
Никол Дж. М., Тернер С. Дж., Койн Д. Л., Нийс Л. д., Хокленд С., Маафи З.Т. (2011). «Текущие нематодные угрозы мировому сельскому хозяйству», в «Геномика и молекулярная генетика взаимодействий растений и нематод» . ред. Джон, Дж., Годелиев, Г., Кармен, Ф. (Дордрехт: Springer), 21–43. doi: 10.1007/978-94-007-0434-3_2
Полный текст CrossRef | Google Scholar
Нивсаркар М., Чериан Б., Падх Х. (2001). Альфа-тертиенил: инсектицид нового поколения растительного происхождения. Курс. науч. 81 (6), 667–672.
Google Scholar
Нежич, Б., Саттер, Н.Д., Моэнс, М. (2010). Влияние Tagetes patula cv Single Gold на Meloidogyne chitwoodi, Pratylenchus penetrans и Steinernema fediae (Бельгия: Магистр Гентского университета).
Google Scholar
Нежич Б., Де Суттер Н., Моэнс М. (2014). Взаимодействие Tagetes patula cv. Сингл Голд с жизненным циклом фитопаразитических нематод Meloidogyne chitwoodi и Pratylenchus penetrans. Рус. Дж. Нематол. 22, 101–108.
Google Scholar
Ока Ю., Оффенбах, Р., Пивония, С. (2004). Совместимость прививки подвоя перца и реакция на Meloidogyne javanica и M-incognita. J. Нематол. 36 (2), 137–141.
Реферат PubMed | Google Scholar
Перри, Р. Н. (2005). Оценка типов аттрактантов, позволяющих нематодам, паразитирующим на растениях, локализовать корни растений. Рус. Дж. Нематол. 13, 83–88.
Google Scholar
Ploeg, AT, Stapleton, JJ (2001). Исследования в теплицах влияния времени, температуры и изменения почвы растительными остатками брокколи на заражение растений дыни Meloidogyne incognita и M-javanica. Нематология 3, 855–861. doi: 10.1163/156854101753625353
CrossRef Полный текст | Google Scholar
Ронн Р., Вестергард М., Экелунд Ф. (2012). Взаимодействие между бактериями, простейшими и нематодами в почве. Акта Протозол. 51 (3), 223–235. doi: 10.4467/168
ap.12.018.0764
CrossRef Full Text | Google Scholar
Рейнольдс А. М., Датта Т. К., Кертис Р. Х. К., Пауэрс С. Дж., Гаур Х. С., Керри Б. Р. (2011). Хемотаксис может привести нематод, паразитирующих на растениях, к источнику хемоаттрактанта кратчайшими возможными путями. JR Soc. Интерфейс 8 (57), 568–577. doi: 10.1098/rsif.2010.0417
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Ризк, А.Ф.М. (1991). Встречающиеся в природе пирролизидиновые алкалоиды (Бока-Ратон, Флорида, США: CRC Press).
Google Scholar
Рюсс, Л., Запата, Э. Дж. Г., Дайтон, Дж. (2000). Пищевые предпочтения грибоядного вида Aphelenchoides. Нематология 2, 223–230. doi: 10.1163/156854100508962
Полный текст CrossRef | Google Scholar
Сантоламацца-Карбоне, С., Веласко, П., Соенгас, П., Картеа, М.Э. (2014). Регуляция травоядных снизу вверх и сверху вниз, опосредованная глюкозинолатами у Brassica oleracea var. ацефала. Экология 174 (3), 893–907. doi: 10.1007/s00442-013-2817-2
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Шенк Х., Дриссен Р. А. Дж., Гелдер Р. Д. (1999). Выяснение структуры соланоэклепина А, естественного фактора вылупления цистообразующих нематод картофеля и томатов, методом рентгеновской дифракции монокристаллов. хорват. хим. Acta 72, 593–606.
Google Scholar
Шольте, К., Вос, Дж. (2000). Влияние потенциальных культур-ловушек и сроков посадки на заражение почвы картофельными цистообразующими нематодами и галловыми нематодами. Энн. заявл. биол. 137, 153–164. doi: 10.1111/j.1744-7348.2000.tb00047.x
Полный текст CrossRef | Google Scholar
Шольте, К. (2000). Скрининг пасленовых, не несущих клубни, на устойчивость и индукцию вылупления ювенильных цистообразующих нематод картофеля и их потенциал для выращивания в ловушки. Энн. заявл. биол. 136, 239–246. doi: 10.1111/j.1744-7348.2000.tb00030.x
Полный текст CrossRef | Google Scholar
Шивакумара, Т. Н., Датта, Т. К., Рао, У. (2018). Новый биоанализ хемотаксиса in vitro для оценки реакции Meloidogyne incognita на различные тестируемые соединения. J. Нематол. 50 (4), 487–494. doi: 10.21307/jofnem-2018-047
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Сильва, Дж. К. П., Кампос, В.P., Barros, A.F., Pedroso, M.P., Terra, W.C., Lopez, L.E., et al. (2018). Летучие вещества растений снижают жизнеспособность галловой нематоды Meloidogyne incognita либо непосредственно, либо при удерживании в воде. Завод Дис. 102 (11), 2170–2179. doi: 10.1094/PDIS-01-18-0143-RE
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Солер-Серратоса, Кокалис-Бурелле Н., Родригес-Кабана Р., Уивер С.Ф., Кинг П.С. (1996). Аллелохимические препараты для борьбы с нематодами, паразитирующими на растениях.1. Нематоцидная эффективность тимола и комбинаций тимола/бензальдегида in vivo. Нематропика 26, 57–71.
Google Scholar
Сориано И. Р., Асенсторфер Р. Э., Шмидт О., Райли И. Т. (2004). Индуцибельный флавон овса (Avena sativa) представляет собой новую защиту от нематод, паразитирующих на растениях. Фитопатология 94, 1207–1214. doi: 10.1094/PHYTO.2004.94.11.1207
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Stegelmeier, B.L.(2011). Токсичные растения, содержащие пирролизидиновые алкалоиды (Senecio, Crotalaria, Cynoglossum, Amsinckia, Heliotropium и Echium spp.). Вет. клин. Север Ам. Еда Аним. Практика. 27 (2), 419–428. doi: 10.1016/j.cvfa.2011.02.013
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Штремель, Н., Бётчер, К., Шмидт, С., Шеел, Д. (2014). Профилирование вторичных метаболитов в корневых экссудатах Arabidopsis thaliana. Фитохимия 108, 35–46. дои: 10.1016/j.phytochem.2014.10.003
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Teillet, A., Dybal, K., Kerry, B.R., Miller, A.J., Curtis, RHC, Hedden, P. (2013). Транскрипционные изменения галловой нематоды Meloidogyne incognita в ответ на корневые сигналы Arabidopsis thaliana. PloS One 8 (4), e61259. doi: 10.1371/journal.pone.0061259
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Тис Дж. А., Леви А., Арисс Дж.Дж., Хассел, Р.Л. (2015). РКВЛ-318, линия арбуза, устойчивая к галловой нематоде, в качестве подвоя для привитого арбуза. Hortscience 50 (1), 141–142. doi: 10.21273/HORTSCI.50.1.141
Полный текст CrossRef | Google Scholar
Тоден, Т. К., Боппре, М., Холлманн, Дж. (2007). Пирролизидиновые алкалоиды Chromolaena odorata действуют как нематоцидные агенты и уменьшают заражение корней салата Meloidogyne incognita. Нематология 9 (3), 343–349. doi: 10.1163/156854107781352016
CrossRef Полный текст | Google Scholar
Тоден, Т.К., Бопре М., Халлманн Дж. (2009a). Влияние пирролизидиновых алкалоидов на жизнедеятельность фитопаразитических и свободноживущих нематод. Борьба с вредителями науч. 65 (7), 823–830. doi: 10.1002/ps.1764
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Тоден Т.С., Халлманн Дж., Боппре М. (2009b). Действие растений, содержащих пирролизидиновые алкалоиды, на северную галловую нематоду Meloidogyne hapla. евро. Дж. Плант Патол. 123 (1), 27–36. дои: 10.1007/s10658-008-9335-9
Полнотекстовая перекрестная ссылка | Google Scholar
Timmermans, BGH, Vos, J., Stomph, TJ, Van Nieuwburg, J., Van Der Putten, P.E.L. (2006). Продолжительность роста и плотность длины корней Solanum sisymbriifolium (Lam.) как определяющие факторы вылупления Globodera pallida (Stone). Энн. заявл. биол. 148 (3), 213–222. doi: 10.1111/j.1744-7348.2006.00056.x
Полный текст CrossRef | Google Scholar
Тимпер П., Дэвис Р. Ф., Тиллман П.Г. (2006). Размножение Meloidogyne incognita на озимых покровных культурах, используемых в хлопководстве. J. Нематол. 38 (1), 83–89.
Реферат PubMed | Google Scholar
Топфер С., Хэй Т., Эрландсон М., Геттель М., Лундгрен Дж. Г., Клиспиес Р. Г. и др. (2009). Обзор естественных врагов жуков в подтрибе Diabroticina (Coleoptera: Chrysomelidae): последствия для устойчивой борьбы с вредителями. Биоконтроль Науч. Технол. 19 (1), 1–65. дои: 10.1080/09583150802524727
Полнотекстовая перекрестная ссылка | Google Scholar
Топалович О., Эльхади А., Халлманн Дж., Ричерт-Поггелер К. Р., Хойер Х. (2019). Бактерии, выделенные из кутикулы нематод, паразитирующих на растениях, прикреплялись к галловой нематоде Meloidogyne hapla и противодействовали ей. наук. Rep. 9, 11477. doi: 10.1038/s41598-019-47942-7
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Trigo, JR (2011). Действие пирролизидиновых алкалоидов на разных трофических уровнях. Фитохим. 10 (1), 83–98. doi: 10.1007/s11101-010-9191-z
CrossRef Полный текст | Google Scholar
Тринговская И., Янкова В., Маркова Д., Михов М. (2015). Влияние растений-компаньонов на выращивание томатов в теплицах. наук. Хортик. 186, 31–37. doi: 10.1016/j.scienta.2015.02.016
CrossRef Полный текст | Google Scholar
Вальдес Ю., Виане Н., Моэнс М. (2012). Влияние внесения желтой горчицы на сообщество почвенных нематод на картофельном поле с упором на Globodera rostochiensis . Заяв. Экологичность почвы. 59, 39–47. doi: 10.1016/j.apsoil.2012.03.011
CrossRef Полный текст | Google Scholar
Вестергард, М., Бьёрнлунд, Л., Кристенсен, С. (2004). Воздействие тли на ризосферные микроорганизмы и микрофауну больше зависит от фазы роста ячменя, чем от удобрения почвы. Экология 141 (1), 84–93. doi: 10.1007/s00442-004-1651-y
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Вестергард, М. (2019). Ловчие культуры для управления Meloidogyne hapla и его интеграции с дополнительными стратегиями. Заяв. Экологичность почвы. 134, 105–110. doi: 10.1016/j.apsoil.2018.10.012
CrossRef Полный текст | Google Scholar
Виейра душ Сантуш, М. К., Кертис, Р. Х. К., Абрантес, И. (2013). Влияние растительных элиситоров на размножение галловой нематоды Meloidogyne chitwoodi на восприимчивых хозяевах. евро. Дж. Плант Патол. 136 (1), 193–202. doi: 10.1007/s10658-012-0155-6
Полный текст CrossRef | Google Scholar
Уокер Т. С., Бэйс Х. П., Халлиган К.М., Стермитц, Ф. Р., Виванко, Дж. М. (2003). Метаболическое профилирование корневых экссудатов Arabidopsis thaliana. Дж. Агрик. Пищевая хим. 51, 2548–2554. doi: 10.1021/jf021166h
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Ван, К., Ли, З., Ханду, З., Классен, В. (2007). Влияние покровных культур на популяции почвенных нематод. Nematropica 37 (1), 79–92.
Google Scholar
Ван, К. Х., Хукс, Ч. Р. Р., Марахатта, С. П. (2011a).Может ли использование системы полосной обработки покровных культур с последующей практикой поверхностного мульчирования улучшить организмы, находящиеся выше в иерархии почвенных пищевых сетей? Заяв. Экологичность почвы. 49, 107–117. doi: 10.1016/j.apsoil.2011.06.008
CrossRef Полный текст | Google Scholar
Ван, К. Х., Сайпс, Б. С., Хукс, Ч. Р. Р. (2011b). Выращивание конопли Sunn и соляризация как альтернатива почвенным фумигантам для выращивания ананасов. Акта Хортик. 902, 221–232. doi: 10.17660/ActaHortic.2011.902.22
Полнотекстовая перекрестная ссылка | Google Scholar
Ван К., Маслер Э. П., Роджерс С. Т. (2018). Реакции инфекционной молоди Heterodera glycines и Meloidogyne incognita на корневые ткани, корневые экссудаты и корневые экстракты трех видов растений. Завод Дис. 102 (9), 1733–1740. doi: 10.1094/PDIS-09-17-1445-RE
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Варнке С. А., Чен С., Вайс Д. Л., Джонсон Г. А., Портер П. М.(2008). Влияние посевов севооборота на выход, жизнеспособность и развитие Heterodera glycines. Нематология 10 (6), 869–882. doi: 10.1163/156854108786161391
CrossRef Full Text | Google Scholar
Wubben, MJE, Su, H., Rodermel, SR, Baum, TJ (2001). Восприимчивость к нематоде цисты сахарной свеклы модулируется передачей сигнала этилена в Arabidopsis thaliana. Мол. Растение-микроб В. 14 (10), 1206–1212. doi: 10.1094/MPMI.2001.14.10.1206
CrossRef Full Text | Google Scholar
Вуйтс, Н., Свеннен, Р., Де Вале, Д. (2006). Влияние продуктов растительного фенилпропаноидного пути и отдельных терпеноидов и алкалоидов на поведение нематод, паразитирующих на растениях, Radopholus similis, Pratylenchus penetrans и Meloidogyne incognita. Нематология 8, 89–101. doi: 10.1163/156854106776179953
CrossRef Full Text | Google Scholar
Xiao, HF, Li, G., Li, DM, Hu, F., Li, HX (2014). Влияние различных видов нематод, питающихся бактериями, на численность, активность и состав сообщества почвенных бактерий. Педосфера 24 (1), 116–124. doi: 10.1016/S1002-0160(13)60086-7
CrossRef Полный текст | Google Scholar
Ян Г., Чжоу Б., Чжан X., Чжан З., Ву Ю., Чжан Ю. и др. (2016). Влияние экссудата корня томата на Meloidogyne incognita. PLoS ONE 11 (4), e0154675. doi: 10.1371/journal.pone.0154675
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Йейтс Г. В., Бонгерс Т., Дегуде Р. Г. М., Фрекман Д. В., Георгиева С.С. (1993). Привычки питания в семействах и родах почвенных нематод — план для почвенных экологов. J. Нематол. 25 (3), 315–331.
Реферат PubMed | Google Scholar
Занон, М. Дж., Гутьеррес, Л. А., Арбиццани, А., Мирта, А. (2014). Борьба с табачными нематодами с помощью диметилдисульфида (DMDS) в Испании и Италии. Акта Хортик. 1044, 375–380. doi: 10.17660/ActaHortic.2014.1044.50
CrossRef Полный текст | Google Scholar
Засада И. А., Мейер, С.Л., Халбрендт, Дж.М., Райс, К. (2005). Активность гидроксамовых кислот из secale crolea в отношении фитопаразитических нематод Meloidogyne incognita и Xiphinema americanum. Фитопатология 95 (10), 1116–1121. doi: 10.1094/PHYTO-95-1116
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Засада И. А., Райс С. П., Мейер С. Л. Ф. (2007). Улучшение использования ржи (Secale зерновых) для борьбы с нематодами: возможность выбора сортов на основе статуса хозяина Meloidogyne incognita и содержания бензоксазиноидов. Нематология 9 (1), 53–60. doi: 10.1163/156854107779969745
CrossRef Полный текст | Google Scholar
Zhang, WP, Ruan, WB, Deng, YY, Gao, YB (2012). Потенциальные антагонистические эффекты девяти натуральных жирных кислот против Meloidogyne incognita. Дж. Агрик. Пищевая хим. 60 (46), 11631–11637. doi: 10.1021/jf3036885
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Чжао X., Шмитт М., Хоуз М. К. (2000). Видозависимые эффекты экссудатов пограничных клеток и кончиков корней на поведение нематод. Фитопатология 90 (11), 1239–1245. doi: 10.1094/PHYTO.2000.90.11.1239
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Сообщество почвенных нематод и продуктивность сельскохозяйственных культур в ответ на 5-летнее добавление биоугля и навоза в почву с желтой корицей | BMC Ecology
Луо Г., Ли Л., Фриман В.П., Го Дж., Го С., Шен К., Линг Н. Органические добавки повышают урожайность за счет улучшения микробно-опосредованного функционирования почвы в агроэкосистемах: метаанализ. Почва Биол Биохим.2018; 124:105–15. https://doi.org/10.1016/j.soilbio.2018.06.002.
КАС Статья Google Scholar
Lehmann J, Joseph S. Biochar для рационального использования окружающей среды: наука, технология и внедрение. 2-е изд. Нью-Йорк: Рутледж; 2015. с. 1–5.
Google Scholar
Gao S, DeLuca TH, Cleveland CC. Добавление биоугля изменяет доступность фосфора и азота в сельскохозяйственных экосистемах: метаанализ.Научная общая среда. 2018; 654: 463–72. https://doi.org/10.1016/j.scitotenv.2018.11.124.
КАС Статья пабмед Google Scholar
Nest TV, Ruysschaert G, Vandecasteele B, Houot S, Baken S, Smolders E, Cougnon M, Reheul D, Merckx R. Долгосрочное использование навоза и компоста: влияние на доступность фосфора, сорбция ортофосфата прочность и выщелачивание Р. Агроэкосистема Окружающая среда. 2016; 216:23–33. https://doi.org/10.1016/j.agee.2015.09.009.
Артикул Google Scholar
Омонди М.О., Ся Х., Нахайо А., Лю Х., Корай П.К., Пан Г. Количественная оценка воздействия биоугля на гидрологические свойства почвы с использованием метаанализа литературных данных. Геодерма. 2016; 274:28–34. https://doi.org/10.1016/j.geoderma.2016.03.029.
КАС Статья Google Scholar
Ван И, Ху Н, Гэ Т, Кузяков Ю, Ван ЗЛ, Ли З, Тан З, Чен И, Ву С, Лу Ю.Агрегация почвы регулирует распределение углерода, активность микробного сообщества и ферментов после 23-летнего внесения поправок в навоз. Прил. Экология почвы. 2017;111:65–72. https://doi.org/10.1016/j.apsoil.2016.11.015.
Артикул Google Scholar
Эльзобаир К.А., Стромбергер М.Е., Ипполито Дж.А., Ленц Р.Д. Противоположные эффекты биоугля по сравнению с навозом на микробные сообщества почвы и активность ферментов в аридисоле. Хемосфера. 2016; 142:145–52.https://doi.org/10.1016/j.chemosphere.2015.06.044.
КАС Статья пабмед Google Scholar
Wang X, Song D, Liang G, Zhang Q, Ai C, Zhou W. Скорость добавления биоугля кукурузы влияет на активность почвенных ферментов и состав микробного сообщества в речно-водной почве. Прил. Экология почвы. 2015;96:265–72. https://doi.org/10.1016/j.apsoil.2015.08.018.
Артикул Google Scholar
Herath HMSK, Camps-Arbestain M, Hedley M. Влияние биоугля на физические свойства почвы в двух контрастных почвах: Alfisol и Andisol. Геодерма. 2013; 209:188–97. https://doi.org/10.1016/j.geoderma.2013.06.016.
КАС Статья Google Scholar
Чжан Л., Цзин Ю., Сян Ю., Чжан Р., Лу Х. Реакция изменений структуры микробного сообщества почвы и активности на добавление биоугля: метаанализ. Научная общая среда.2018; 643: 926–35. https://doi.org/10.1016/j.scitotenv.2018.06.231.
КАС Статья пабмед Google Scholar
Ван Цвитен Л., Кимбер С., Моррис С., Чан К.Ю., Дауни А., Раст Дж., Джозеф С., Коуи А. Влияние биоугля из медленного пиролиза отходов бумажной фабрики на агрономические показатели и плодородие почвы. Растительная почва. 2010; 327: 235–46. https://doi.org/10.1007/s11104-009-0050-x.
КАС Статья Google Scholar
Вейерс С.Л., Спокас К.А. Влияние биоугля на популяции дождевых червей: обзор. Appl Environment Soil Sci. 2011;2011:541592. https://doi.org/10.1155/2011/541592.
Артикул Google Scholar
Zhang X, Li Q, Liang W, Zhang M, Bao X, Xie Z. Реакция почвенных нематод на добавление биоугля на китайском пшеничном поле. Педосфера. 2013; 23:98–103. https://doi.org/10.1016/S1002-0160(12)60084-8.
КАС Статья Google Scholar
Феррис Х. Форма и функция: метаболические следы нематод в пищевой цепи почвы. Eur J Soil Biol. 2010;46:97–104. https://doi.org/10.1016/j.ejsobi.2010.01.003.
Артикул Google Scholar
Ван Ден Хуген Дж., Гейзен С., Рут Д., Феррис Х., Траунспургер В., Уордл Д.А., Барджетт Р.Д. Численность почвенных нематод и состав функциональных групп в глобальном масштабе. Природа. 2019; 572: 194–8. https://doi.org/10.1038/s41586-019-1418-6.
КАС Статья пабмед Google Scholar
Дай Л., Ли Х., Тан Ф., Чжу Н., Хе М., Хум Г. Биоуголь: потенциальный способ переработки фосфора в сельскохозяйственных отходах. GCB Биоэнергетика. 2016; 8: 852–8. https://doi.org/10.1111/gcbb.12365.
КАС Статья Google Scholar
Лю Т., Чен Х., Ху Ф., Ран В., Шен К., Ли Х., Уэйлен Дж.К. Богатые углеродом органические удобрения для увеличения биоразнообразия почвы: данные метаанализа сообществ нематод.Агроэкосистема Окружающая среда. 2016; 232:199–207. https://doi.org/10.1016/j.agee.2016.07.015.
Артикул Google Scholar
Zheng F, Zhu D, Giles M, Daniell T, Neilson R, Zhu Y, Yang X. Минеральные и органические удобрения изменяют микробиом почвенной нематоды Dorylaimus stagnalis и ее резистом. Научная общая среда. 2019;680:70–8. https://doi.org/10.1016/j.scitotenv.2019.04.384.
КАС Статья пабмед Google Scholar
Li J, Wang D, Fan W, He R, Yao Y, Sun L, Zhao X, Wu J. Сравнительное воздействие различных органических материалов на сообщество нематод в непрерывной монокультуре сои. Прил. Экология почвы. 2018;125:12–7. https://doi.org/10.1016/j.apsoil.2017.12.013.
Артикул Google Scholar
Liang W, Lou Y, Li Q, Zhong S, Zhang X, Wang J. Реакция фауны нематод на длительное применение азотных удобрений и органических удобрений в Северо-Восточном Китае.Почва Биол Биохим. 2009;41:883–90. https://doi.org/10.1016/j.soilbio.2008.06.018.
КАС Статья Google Scholar
Pan F, Han X, Li N, Yan J, Xu Y. Влияние количества органической добавки на структуру сообщества почвенных нематод и метаболические следы в соевой фазе севооборота соя-кукуруза в Mollisols. Педосфера. 2017; 30: 544–54. https://doi.org/10.1016/S1002-0160(17)60432-6.
Артикул Google Scholar
Гриффитс Б., Болл Б., Даниэлл Т., Халлетт П., Нейлсон Р., Уитли Р., Ослер Г., Боханек М. Интеграция изменений качества почвы в пахотные сельскохозяйственные системы после добавления органических веществ или принятия лей-пахотного севооборота. Прил. Экология почвы. 2010;46:43–53. https://doi.org/10.1016/j.apsoil.2010.06.012.
Артикул Google Scholar
Villenave C, Saj S, Pablo AL, Sall S, Djigal D, Chotte JL, Bonzi M. Влияние долгосрочных органических и минеральных удобрений на почвенную нематофауну при выращивании Sorghum bicolor в Буркина-Фасо.Биол Плодородные почвы. 2010; 46: 659–70. https://doi.org/10.1007/s00374-010-0471-y.
КАС Статья Google Scholar
Thoden TC, Korthals GW, Termorshuizen AJ. Органические поправки и их влияние на паразитирующих на растениях и свободноживущих нематодах: многообещающий метод борьбы с нематодами? Нематология. 2011;13:133–53. https://doi.org/10.1163/138855410X541834.
Артикул Google Scholar
Такахиро И., Араки М., Комацудзаки М., Канеко Н., Охта Х. Структура сообщества почвенных нематод, затронутая системами обработки почвы и управлением покровными культурами в органическом производстве сои. Прил. Экология почвы. 2015; 86: 137–47. https://doi.org/10.1016/j.apsoil.2014.10.003.
Артикул Google Scholar
Yu H, Ding W, Luo J, Geng R, Cai Z. Долгосрочное применение органических удобрений и минеральных удобрений на агрегацию и связанный с агрегатами углерод в супесчаной почве.Почва до рез. 2012; 124:170–7. https://doi.org/10.1016/j.still.2012.06.011.
Артикул Google Scholar
Чен ZX, Чен С.Ю., Диксон Д.В. Нематология: достижения и перспективы. Том 1: Морфология, физиология и экология нематод, CABI Publishing, Пекин, Китай, 2004.
Yeates GW. Влияние растений на структуру сообщества нематод. Анну Рев Фитопат. 1999; 37: 127–49. https://doi.org/10.1146/annurev.фито.37.1.127.
КАС Статья пабмед Google Scholar
Неер Д.А., Вейхт Т.Р., Барберчек М.Э. Связь сообществ беспозвоночных со скоростью разложения и доступностью азота в почвах соснового леса. Прил. Экология почвы. 2012; 54:14–23. https://doi.org/10.1016/j.apsoil.2011.12.001.
Артикул Google Scholar
Li Q, Jiang Y, Liang W, Lou Y, Zhang E, Liang C.Долгосрочное влияние управления плодородием на сообщество почвенных нематод в овощеводстве в тепличных условиях. Прил. Экология почвы. 2010;46:111–8. https://doi.org/10.1016/j.apsoil.2010.06.016.
Артикул Google Scholar
Li X, Liu C, Zhao H, Gao F, Ji G, Hu F, Li H. Подобные положительные эффекты полезных бактерий, нематод и дождевых червей на качество почвы и продуктивность. Прил. Экология почвы. 2018;130:202–8. https://дои.org/10.1016/j.apsoil.2018.06.016.
Артикул Google Scholar
Чжан Фр. Педогеография. 1-е изд. Пекин: Китайская сельскохозяйственная пресса; 2002. с. 113–25.
Google Scholar
Sohlenius B. Влияние кормовой базы на структуру популяции и распределение по длине Acrobeloides nanus Nematoda: Cephalobidae. Педобиологи. 1973 год; 205-213.
Элад Ю., Цитрин Э., Харел Ю.М., Лью Б., Грабер Э.Р. Эффект биоугля: устойчивость растений к биотическим стрессам. Фитопатол Медитерр. 2011;50:335–49.
Google Scholar
Liu X, Zhang A, Ji C, Joseph S, Bian R, Li L, Pan G, Paz-Ferreiro J. Влияние Biochar на продуктивность сельскохозяйственных культур и зависимость от экспериментальных условий — метаанализ литературы данные. Растительная почва. 2013; 373: 583–94. https://doi.org/10.1007/s11104-013-1806-x.
КАС Статья Google Scholar
Li BY, Zhou DM, Cang L, Zhang HL, Fan XH, Qin SW. Доступность питательных микроэлементов в почве для сельскохозяйственных культур в зависимости от долгосрочного применения неорганических и органических удобрений. Почва до рез. 2007; 96: 166–73. https://doi.org/10.1016/j.still.2007.05.005.
Артикул Google Scholar
Ву Х, Цзэн Г, Лян Дж, Чен Дж, Сюй Дж, Дай Дж, Ли Х, Чен М, Сюй П, Чжоу Й, Ли Ф, Ху Л, Ван Дж.Реакции бактериального сообщества и функциональных маркерных генов круговорота азота на биоуголь, компост и комбинированные удобрения в почве. Приложение Microbiol Biotechnol. 2016; 100:8583–91. https://doi.org/10.1007/s00253-016-7614-5.
КАС Статья пабмед Google Scholar
Chen D, Zheng S, Shan Y, Taube F, Bai Y. Изменения в растениях и почвах, вызванные травоядными позвоночными: связь с функционированием экосистем в полузасушливой степи.Функция Экол. 2013; 27: 273–81. https://doi.org/10.1111/1365-2435.12027.
Артикул Google Scholar
Эйзенхауэр Н., Цезарц С., Коллер Р., Ворм К., Райх П.Б. Глобальные изменения под землей: воздействие повышенного содержания CO 2 , азота и летней засухи на пищевые сети почвы и биоразнообразие. Глоб Изменение Биол. 2012;18:435–47. https://doi.org/10.1111/j.1365-2486.2011.02555.x.
Артикул Google Scholar
Олмо М., Вильяр Р., Салазар П., Альбуркерке Дж.А. Изменения в доступности питательных веществ в почве объясняют влияние биоугля на развитие корней пшеницы. Растительная почва. 2016; 399: 333–43. https://doi.org/10.1007/s11104-015-2700-5.
КАС Статья Google Scholar
Вэнь З., Хен Дж., Блэквелл М., Ли Х., Чжао Б., Юань Х. Комбинированное применение азотных и фосфорных удобрений с навозом увеличивает урожай кукурузы и поглощение питательных веществ за счет стимуляции роста корней в долгосрочном эксперименте.Педосфера. 2016;26:62–73. https://doi.org/10.1016/S1002-0160(15)60023-6.
КАС Статья Google Scholar
Zhou H, Zhang D, Wang P, Liu X, Cheng K, Li L, Zheng J, Zhang X, Zheng J, Crowley D, Zwieten LV, Pan G. Изменения микробной биомассы и метаболического коэффициента с добавлением биоугля в сельскохозяйственные почвы: метаанализ. Агроэкосистема Окружающая среда. 2017;239:80–9. https://doi.org/10.1016/j.agee.2017.01.006.
КАС Статья Google Scholar
Liu T, Ye C, Li Y, Chen X, Ran W, Shen Q, Hu F, Li H. Влияние различных органических удобрений на почвенных нематод в ризосфере рисовых и пшеничных пахотных земель. Акта Эколь Син. 2015; 35: 6259–68. https://doi.org/10.5846/stxb201402160264. (на китайском языке)
Артикул Google Scholar
Ye C. Нематодная фауна, реагирующая на управление внесением удобрений при выращивании кукурузы и пшеницы в северном Китае, Диссертация, Нанкинский сельскохозяйственный университет, Нанкин, Китай, 2014.
Hu C, Qi Y. Влияние компоста и химических удобрений на сообщество почвенных нематод на кукурузном поле в Китае. Eur J Soil Biol. 2010;46:230–6. https://doi.org/10.1016/j.ejsobi.2010.04.002.
КАС Статья Google Scholar
Обиа А., Малдер Дж., Мартинсен В., Корнелиссен Г., Борресен Т. Влияние биоугля in situ на агрегацию, удержание воды и пористость в легких тропических почвах. Почва до рез.2016; 155:35–44. https://doi.org/10.1016/j.still.2015.08.002.
Артикул Google Scholar
Таммеорг П., Симойоки А., Мякеля П., Стоддард Ф.Л., Алакукку Л., Хелениус Дж. Применение биоугля на плодородных супесчаных почвах в бореальных условиях: влияние на свойства почвы и формирование урожая пшеницы, репы, рапса и конских растений боб. Растительная почва. 2014; 374:89–107. https://doi.org/10.1007/s11104-013-1851-5.
КАС Статья Google Scholar
Чапарро Дж.М., Шефлин А.М., Мантер Д.К., Виванко Дж.М. Манипулирование микробиомом почвы для улучшения здоровья почвы и плодородия растений. Биол Плодородные почвы. 2012; 48: 489–99. https://doi.org/10.1007/s00374-012-0691-4.
Артикул Google Scholar
Тангараджан Р., Болан Н.С., Тиан Г., Найду Р., Кунхикришнан А. Роль внесения органических добавок в выбросы парниковых газов из почвы. Научная общая среда. 2013; 465:72–96. https://дои.org/10.1016/j.scitotenv.2013.01.031.
КАС Статья пабмед Google Scholar
Миллер Дж.Дж., Бремер Э., Бизли Б.В., Друри С.Ф., Зебарт Б.Дж., Ларни Ф.Дж. Длительное влияние свежего и компостированного навоза крупного рогатого скота на размер и питательный состав сухих просеянных почвенных агрегатов. Может ли J Soil Sci. 2012; 92: 673–83. https://doi.org/10.4141/cjss2011-056.
Артикул Google Scholar
Эллисон С.Д., Мартини Дж.Б. Устойчивость, устойчивость и избыточность в микробных сообществах. Proc Natl Acad Sci. 2008; 105 (Приложение 1): 11512–9. https://doi.org/10.1073/pnas.0801
Артикул пабмед Google Scholar
Сеуферт В., Раманкутти Н., Фоли Дж.А. Сравнение урожайности органического и традиционного земледелия. Природа. 2012; 485: 229–32. https://doi.org/10.1038/nature11069.
КАС Статья пабмед Google Scholar
Tounkara A, Clermont-Dauphin C, Affholder F, Ndiaye S, Masse D, Cournac L. Эффективность использования неорганических удобрений для посевов проса повысилась за счет применения органических удобрений в богарном земледелии на приусадебных участках в центральном Сенегале. Агроэкосистема Окружающая среда. 2020;294:106878. https://doi.org/10.1016/j.agee.2020.106878.
КАС Статья Google Scholar
Cordovil CDS, Coutinho J, Goss M, Cabral F. Потенциально минерализуемый азот из органических материалов, нанесенный на песчаную почву: соответствие экспоненциальной модели с одним бассейном.Управление использованием почвы. 2005; 21: 65–72. https://doi.org/10.1111/j.1475-2743.2005.tb00108.x.
Артикул Google Scholar
Боулз ТМ, Акоста-Мартинес В., Кальдерон Ф., Джексон Л.Е. Активность почвенных ферментов, микробные сообщества и доступность углерода и азота в органических агроэкосистемах на интенсивно управляемом сельскохозяйственном ландшафте. Почва Биол Биохим. 2014;68:252–62. https://doi.org/10.1016/j.soilbio.2013.10.004.
КАС Статья Google Scholar
Джеффри С., Верхейен Ф.Г., ван дер Вельде М., Бастос А.С. Количественный обзор влияния внесения биоугля в почву на урожайность сельскохозяйственных культур с использованием метаанализа. Агроэкосистема Окружающая среда. 2011; 144:175–87. https://doi.org/10.1016/j.agee.2011.08.015.
Артикул Google Scholar
Джозеф С.Д., Кэмпс-Арбестайн М., Лин И., Манро П., Чиа К.Х., Крюк Дж. Исследование реакций биоугля в почве. Почва Res. 2010;48:501–15.https://doi.org/10.1071/SR10009.
КАС Статья Google Scholar
Nguyen TTN, Xu CY, Tahmasbian I, Che R, Xu Z, Zhou X, Wallace HM, Bai SH. Влияние биоугля на доступный в почве неорганический азот: обзор и метаанализ. Геодерма. 2017; 288:79–96. https://doi.org/10.1016/j.geoderma.2016.11.004.
КАС Статья Google Scholar
Гонг З., Чжан Г., Чен З.Разработка классификации почв в Китае. В: Эсваран Х., Райс Т., Аренс Р., Стюарт Б.А., редакторы. Классификация почв: глобальный настольный справочник. CRC, Вашингтон: округ Колумбия; 2003. с. 101–25 (на китайском языке) .
Google Scholar
Pan G, Lin Z, Li L, Zhang A, Zheng J, Zhang X. Перспективы индустриализации биомассы углерода органических отходов сельского хозяйства и сельских районов в Китае. J Сельскохозяйственная наука Tech. 2011;13:75–82. https://дои.org/10.3969/j.issn.1008-0864.2011.01.12. (на китайском языке)
Артикул Google Scholar
Лу Р. Почвенные и агрохимические методы анализа. Китай: Издательство сельскохозяйственных наук и технологий. Пекин; 2000. с. 205–66.
Google Scholar
Де Кляйн САМ, Харви М.Дж. Руководство по методологии камеры с закисью азота, версия 1.1, Министерство первичной промышленности.Веллингтон, Новая Зеландия, 2015 г.; стр. 34-91.
Стеммер М., Герзабек М.Х., Канделер Э. Активность органического вещества и ферментов в гранулометрических фракциях почв, полученных после низкоэнергетической обработки ультразвуком. Почва Биол Биохим. 1998; 30:9–17. https://doi.org/10.1016/S0038-0717(97)00093-X.
КАС Статья Google Scholar
Liu M, Chen X, Qin J, Wang D, Griffiths B, Hu F. Процедура последовательного извлечения показывает, что управление водными ресурсами влияет на сообщества почвенных нематод на рисовых полях.Прил. Экология почвы. 2008;40:250–9. https://doi.org/10.1016/j.apsoil.2008.05.001.
Артикул Google Scholar
Кузница Т.А., Биттман С., Коваленко С.Г. Реакция пастбищных почвенных нематод и простейших на многолетнее и однолетнее применение навозной жижи и удобрений. Почва Биол Биохим. 2005; 37: 1751–62. https://doi.org/10.1016/j.soilbio.2004.11.013.
КАС Статья Google Scholar
Инь В. Иллюстрированные определители почвенных животных Китая. Пекин: China Science Press; 1998.
Google Scholar
Йейтс Г.В., Бонгерс Т.Д., Де Гёде Р.Г.М., Фрекман Д.В., Георгиева С.С. Привычки питания в семействах и родах почвенных нематод — план для почвенных экологов. J Нематол. 1993; 25: 315–31.
КАС пабмед ПабМед Центральный Google Scholar
Бонгерс Т., Бонгерс М.Функциональное разнообразие нематод. Прил. Экология почвы. 1998; 10: 239–51. https://doi.org/10.1016/S0929-1393(98)00123-1.
Артикул Google Scholar
Jiang C, Sun B, Li H, Jiang Y. Детерминанты сезонного изменения состава сообщества нематод при длительном применении органических удобрений в кислой почве в субтропическом Китае. Eur J Soil Biol. 2013;55:91–9. https://doi.org/10.1016/j.ejsobi.2012.11.003.
Артикул Google Scholar
Андерсон Т.Х., Домш К.Х. Метаболический коэффициент для CO 2 (qCO 2 ) как специфический параметр активности для оценки влияния условий окружающей среды, таких как pH, на микробную биомассу лесных почв. Почва Биол Биохим. 1993; 25: 393–5. https://doi.org/10.1016/0038-0717(93)
Артикул Google Scholar
Биоразнообразие почвенных нематод | SpringerLink
Арпин П., Понж Ж-Ф (1986) Влияние недавней имплантации булавки Сильвестра на поведение нематофауны солнц, по сравнению с народом feuillu pur et un peuplement mélange.Педобиология 29:391–404
Google Scholar
Baird SM, Bernard EC (1984) Популяция нематод и динамика сообществ в режимах возделывания сои и пшеницы и обработки почвы. Дж Нематол 16: 379–386
Google Scholar
Бединг Р.А. (1967) Паразитические и свободноживущие циклы у энтомогенных нематод рода Deladenus . Природа (Лондон) 214:174–175
Google Scholar
Бонгерс Т. (1986) Нематоды в биоэкосистеме.Молм 6:20–30
Google Scholar
Bongers T (1988) De nematoden van Nederland. Koninklijke Nederlandse Natuurhistorische Vereiniging Утрехт, Нидерланды
Google Scholar
Bongers T (1990) Индекс зрелости: экологическая мера нарушения окружающей среды, основанная на видовом составе нематод. Экология 83:14–19
Google Scholar
Boström S, Sohlenius B (1986) Краткосрочная динамика сообществ нематод в пахотных почвах: влияние многолетней и однолетней системы земледелия.Педобиология 29:345–357
Google Scholar
Coomans A (1989) Overzicht van de vrijlevende nematofauna van België. Verh Symp Invert Belgie, стр. 43–56
Dmowska E, Kołowska J (1988) Сообщества нематод в почве, обработанной полужидким навозом. Педобиология 32:323–330
Google Scholar
Фолкнер Л.Р., Дарлинг Х.М. (1961) Патологическая гистология, хозяева и культура нематоды картофельной гнили.Фитопатология 51:778–786
Google Scholar
Феррис В.Р. (1989) Зачем экологам нужны систематики: важность систематики в экологических исследованиях. Дж Нематол 21: 308–314
Google Scholar
Феррис В.Р., Феррис Дж.М. (1972) Взаимоотношения между нематодами и растительными сообществами в сельскохозяйственных экосистемах. Агроэкосистемы 1:275–299
Google Scholar
Forge TA, MacGuidwin AE (1990) Холодное закаливание Meloidogyne hapla молодых особей второй стадии.Дж. Нематол 22:105–110
Google Scholar
Fortuner R (ed) (1988) Технология идентификации нематод и экспертных систем. Пленум Пресс, Нью-Йорк
Google Scholar
Freckman DW (ed) (1982) Нематоды в почвенных экосистемах. Техасский университет Press, Остин, Техас
Google Scholar
Freckman DW, Caswell EP (1985) Экология нематод в агроэкосистемах.Annu Rev Phytopathol 23: 275–296
Google Scholar
Freckman DW, Whitford WG, Steinberger Y (1987) Влияние орошения на динамику популяции и активность нематод в почвах пустынь. Биол Плодородные почвы 3:3–10
Google Scholar
Gowen SR (1971) Tylenchus emarginatus и Tylenchorhynchus dubius , связанные с сеянцами ели ситхинской ( Picea sitchensis ).Плаут Патол 20: 69–72
Google Scholar
Huettel RN, Dickson DW, Kaplan DT (1984) Radopholus citrophilus sp. н. (Nematoda), родственный вид Radopholus similis . Proc Helminthol Soc Wash 51:32–35
Google Scholar
Ingham RE, Trofymow JA, Ingham ER, Coleman DC (1985) Взаимодействие бактерий, грибков и их нематод: влияние на круговорот питательных веществ и рост растений.Экол Моногр 55:119–140
Google Scholar
Джонсон С.Р., Феррис В.Р., Феррис Дж.М. (1972) Структура сообщества нематод на лесных участках: I. Отношения, основанные на коэффициентах сходства видов нематод. Дж. Нематол 4:175–183
Google Scholar
Джонсон С.Р., Феррис Дж.М., Феррис В.Р. (1973) Структура сообщества нематод на лесных участках: II. Ординация нематодных сообществ.J Нематол 5: 95–107
Google Scholar
Джонсон С.Р., Феррис Дж.М., Феррис В.Р. (1974) Структура сообщества нематод лесных участков: III. Ординации таксономических групп и биомассы. J Нематол 6: 118–126
Google Scholar
Джуман Н.Г., Мишра С.С. (1988) Влияние однолетней и многолетней культуры на динамику трофической группы нематод. Can J Soil Sci 68: 101–109
Google Scholar
Khera S, Zuckerman BM (1963) Исследования in vitro взаимоотношений хозяев и паразитов некоторых нематод, паразитирующих на растениях.Nematologica 9:1–6
Google Scholar
Magnusson C (1983) Численность и трофическая структура нематод соснового леса в зависимости от слоев почвы и напочвенного покрова. Holarc Ecol 6:175–182
Google Scholar
Ниблэк Т.Л. (1989) Применение исследования структуры сообщества нематод к сельскохозяйственному производству и нарушению среды обитания. Дж Нематол 21: 437–443
Google Scholar
Niblack TL, Bernard EC (1985a) Структура сообщества нематод в питомниках кизила, клена и персика в Теннесси.Дж Нематол 17: 126–131
Google Scholar
Niblack TL, Bernard EC (1985b) Сообщества нематод, паразитирующих на растениях, в питомниках кизила, клена и персика в Теннесси. Дж Нематол 17: 132–139
Google Scholar
Николас В.Л. (1984) Биология свободноживущих нематод. Кларендон, Оксфорд
Google Scholar
Norton DC (1978) Экология нематод, паразитирующих на растениях.Джон Уайли, Нью-Йорк
Google Scholar
Norton DC (1987) Сообщества растительных нематод. Int J Parasitol 17: 215–222
Google Scholar
Нортон Д.К., Шмитт Д.П. (1978) Общинный анализ нематод, паразитирующих на растениях, в прерии Калсоу, Айова. Дж. Нематол 10:171–176
Google Scholar
Одум Е.П. (1971) Основы экологии.WB Saunders, Филадельфия
Google Scholar
Пит Р.К. (1974) Измерение разнообразия видов. Annu Rev Ecol Syst 5:285–307
Google Scholar
Pickup J (1990a) Сезонные колебания холодостойкости трех видов свободноживущих антарктических нематод. Функция Ecol 4:257–264
Google Scholar
Pickup J (1990b) Стратегии холодостойкости трех видов антарктических дорилаимидных нематод.J Comp Physiol B 160:167–173
Google Scholar
Procter DLC (1990) Глобальный обзор функциональных ролей почвенных нематод в наземных сообществах и экосистемах. Дж. Нематол 22:1–7
Google Scholar
Remillet M, Laumond C (1991) Spaerularioid нематоды, имеющие важное значение в сельском хозяйстве. В: Nickle WR (ed) Руководство по сельскохозяйственной нематологии. Марсель Деккер, Нью-Йорк, стр. 967–1024
Google Scholar
Schulte F (1989) История жизни Rhabditis (Pelodera) orbitalis — личиночный паразит глазных орбит арвиколидных и мышевидных грызунов.Proc Helminthol Soc Wash 56:1–7
Google Scholar
Singh RV, Khera S (1982) Исследования in vitro питания некоторых нематод, паразитирующих на растениях. Индиан Дж. Нематол 12: 31–37
Google Scholar
Малый RW (1987) Обзор добычи хищных почвенных нематод. Педобиология 30:179–206
Google Scholar
Смолик Дж.Д., Льюис Дж.К. (1982) Влияние условий обитания на плотность и биомассу нематод в смешанной экосистеме прерий.J Управление диапазоном 35:657–663
Google Scholar
Sohlenius B (1980) Численность, биомасса и вклад почвенных нематод в поток энергии в наземных экосистемах. Ойкос 34:186–194
Google Scholar
Солениус Б., Бострём С., Сандор А. (1987) Долгосрочная динамика сообществ нематод в пахотных почвах при четырех режимах возделывания культур. J Appl Ecol 24:131–144
Google Scholar
Sohlenius B, Boström S, Sandor A (1988) Баланс углерода и азота нематод в пахотной почве.Биол Плодородные почвы 6:1–8
Google Scholar
Volz P (1951) Untersuchungen über die Microfauna des Waldbodens. Zool Jahrb Abt Syst Ökol Geogr Tiere 79: 514–566
Google Scholar
Василевская Л. (1971) Нематоды дюн Кампиносского леса: II. Структура сообщества в зависимости от количества особей, состояния биомассы и дыхательного метаболизма. Экол Пол 19:651–688
Google Scholar
Westcott SW III, Barker KR (1976) Взаимодействие Acrobeloides buetschlii и Rhizobium leguminosarum на горохе Wando.Фитопатология 66:468–472
Google Scholar
Уортон Д.А. (1986) Функциональная биология нематод. Джонс Хопкинс, Балтимор
Google Scholar
Wheeler QD (1990) Разнообразие насекомых и кладистические ограничения. Энн Энтомол Soc Am 83: 1031–1047
Google Scholar
Wolda H (1981) Индексы сходства, размер выборки и разнообразие.Экология 50:296–302
Google Scholar
Womersley C (1987) Переоценка стратегий, используемых ангидробиотами-нематодами по отношению к их естественной среде. В: Veech JA, Dickson DW (eds) Vistas on nematology. Общество нематологов Хаятсвилл, Мэриленд, стр. 165–173
Google Scholar
Wood FH (1973a) Жизненный цикл и отношения хозяин-паразит Aglenchus costatus (de Man, 1921) Meyl, 1961 (Nematoda: Tylenchidae).NZ J Agric Res 16: 373–380
Google Scholar
Wood FH (1973b) Пищевые отношения нематод: Пищевые отношения почвенных нематод. Soil Biol Biochem 5:593–601
Google Scholar
Yeates GW (1979) Почвенные нематоды в наземных экосистемах. Дж Нематол 11: 213–229
Google Scholar
Yeates GW (1984) Изменение разнообразия почвенных нематод на пастбищах в зависимости от почвы и года.
